

·前言·
胃癌是全球常见癌症及主要致死病因之一,以手术为主的系统治疗预后不佳,免疫检查点抑制剂联合化疗虽有进展,但仍面临挑战,寻找新免疫治疗靶点和筛选敏感患者至关重要。
在2025年一月发表在《Journal for ImmunoTherapy of Cancer》杂志上的一篇研究论文中,来自上海交通大学瑞金医院的研究人员聚焦于 SIGLEC11 在胃癌中的表达和功能,揭示了 SIGLEC11 在胃癌免疫微环境中的表达特性及其促进 M2 型巨噬细胞极化的机制,为胃癌免疫抑制的分子机制提供了新视角,为临床开发新的免疫检查点抑制剂或靶向药物提供了依据。
·文章简介·
1.首先通过对癌症基因组图谱(TCGA)- 胃腺癌(STAD)的数据进行处理和分析,展示了SIGLEC 家族基因的全面 mRNA 表达情况。研究人员还同时对比了肿瘤组织和正常组织SIGLEC11 的 mRNA 表达丰度,得出如下结论:SIGLEC11 在胃癌中表达水平较低,且与不良预后相关。
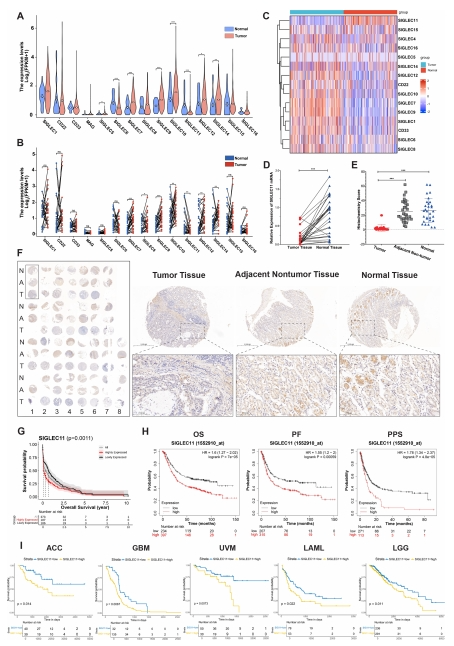
图 1 SIGLEC11 在胃癌中表达较低,且与胃癌预后相关。(A)箱线图展示了利用癌症基因组图谱(TCGA)的 RNA 测序数据,对正常组织和胃癌组织的数据进行 log2(每百万转录本数 +1,TPM+1)标准化后,SIGLEC 家族基因的表达情况。(B)箱线图展示了利用 TCGA 的 RNA 测序数据,对配对的正常组织和胃癌组织的数据进行 log2(TPM+1)标准化后,SIGLEC 的表达情况。(C)基于基因表达综合数据库(GEO,GSE 183436)的数据,对肿瘤组织和正常组织进行 RNA 测序数据分析,并以热图形式呈现。(D)30 对胃癌组织及其配对的正常组织中 SIGLEC11 的 mRNA 水平。(E)展示了肿瘤组织、非肿瘤组织和正常组织中 SIGLEC11 的免疫组织化学染色评分。(H)生存曲线用于分析 GEO 数据库中 SIGLEC11 低表达组和高表达组的总生存期(OS)、无进展生存期(PPS)和无进展生存期(PF)。
2. 其次,研究人员对SIGLEC11在肿瘤微环境中的表达模式进行分析,发现 SIGLEC11在肿瘤组织 TAMs 中选择性上调,在 M2 巨噬细胞中高表达并促使巨噬细胞向 M2 表型极化,同时SIGLEC11 过表达增强巨噬细胞免疫抑制能力。
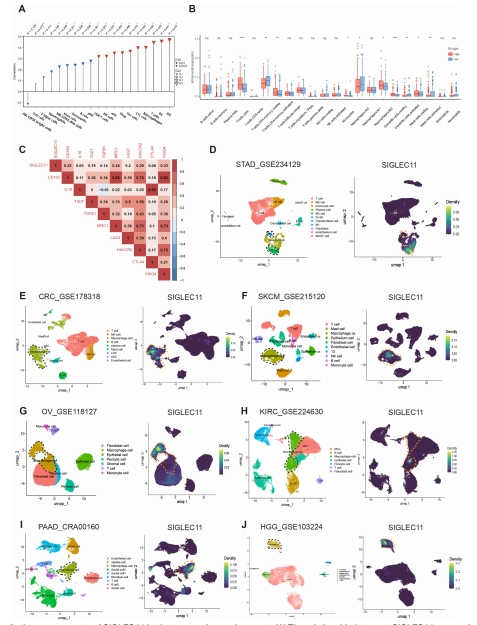
图2
图2 (C)在癌症基因组图谱(TCGA)的胃腺癌(STAD)数据库中,唾液酸结合免疫球蛋白样凝集素 11(SIGLEC11)与免疫抑制基因之间的相关性。(D)利用泛癌单细胞测序数据集对肿瘤中唾液酸结合免疫球蛋白样凝集素 11(SIGLEC11)基因的表达情况进行分析。(L)通过酶联免疫吸附测定法(ELISA)检测了白细胞介素 - 10(IL-10)、转化生长因子 β1(TGFβ1)、白细胞介素 - 6(IL-6)和巨噬细胞集落刺激因子(M-CSF)的表达水平。THP-1(白血病单核细胞);Monocyte-derived macrophage(单核细胞衍生的巨噬细胞)
3. 研究人员进一步研究发现:SIGLEC11通过激活 AKT - mTOR 信号通路促进巨噬细胞向 M2 表型极化,进而加速胃癌进展。
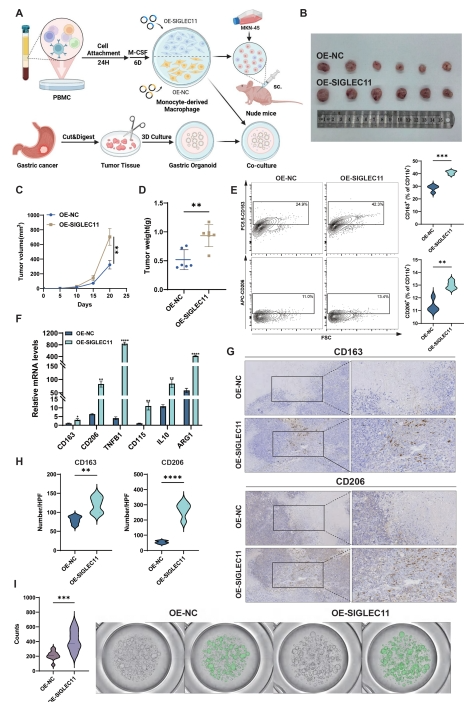
图3 (A)气泡图展示了SIGLEC11过表达时,多种信号通路相关基因的富集结果(B)小鼠胃癌模型中胃癌组织与过表达 SIGLEC11 的巨噬细胞共培养结果(C)人源胃癌类器官与过表达 SIGLEC11 的巨噬细胞共培养结果
文章中明确指出,Castor S1用于拍摄PDO(类器官)的形态,AI软件可以识别类器官(绿色标记出类器官)并进行统计。

4.文章得出如下结论:唾液酸结合免疫球蛋白样凝集素 11(SIGLEC11)能通过激活 AKT - mTOR 信号通路促进巨噬细胞向 M2 表型极化,进而加速胃癌进展。这表明 SIGLEC11 + M2 样巨噬细胞浸润肿瘤或可作为识别胃癌免疫抑制亚型的生物标志物,为胃癌免疫治疗提供了新的潜在靶点。
组织和正常组织SIGLEC11 的 mRNA 表达丰度,得出如下结论:SIGLEC11 在胃癌中表达水平较低,且与不良预后相关。
·总结·
类器官由于具有组织同源性高,易于体外基因编辑和操作,可短时间大量扩增等特点,近年来越来越成为重要的体外研究模型。艾力特公司的高通量智能3D细胞成像系统Countstar Castor为高通量类器官成像分析提供全新的解决方案,系统标配四色荧光通道(蓝 / 绿 / 红/近红外),搭载 4x、10x和20x 物镜,可以捕获高分辨率类器官图像。先进的 Z 轴层扫技术和 AI 驱动的图像处理算法,大幅缩短 3D 图像采集时间,提高识别准确度,是类器官形态分析、荧光活率检测、药敏和细胞毒性评价的理想平台。
·文献原文下载·
