Algae
微藻在水生生态系统中发挥着重要作用,是初级生产和生物质化学循环的重要组成。基于高效液相色谱以及拉曼光谱法的色素分析技术,是传统微藻分类学的经典方法。然而,环境因素(如光照、营养状况、温度和生长阶段)对微藻的色素组成有显著影响,导致色素的光谱变异性显著增加,由此引出藻类学研究中的基本挑战:如何在单细胞水平上准确评估其色素组成、分类多样性和生理状态。
Spectral flow cytometry
色素在藻类生理中起着关键作用,驱动光合作用、光保护和应激反应。色素差异不仅帮助细胞适应环境条件,还可作为基于独特色素组成的分类标记。藻类色素分析传统上依赖于高效液相色谱,无法实现单细胞维度的精确分析。相比之下,全光谱流式细胞术已成为一种高通量、单细胞的替代方法,不仅提供细胞大小和散射光信息,同时在多个激发波长下捕获完整的自发荧光(AF)光谱。来自纳扎尔巴耶夫大学的研究者,已成功将索尼ID7000全光谱流式分析仪引入到合成藻类-微生物群落分析的研究领域,利用色素的光谱变异性,实现了从物种鉴定计数到群落组成和进化动力学的高通量分析,极大拓展了全光谱流式技术的应用领域(Sony ID7000全光谱流式建立自发荧光指纹库,助力藻类-微生物群落生态学研究)。

在此基础上,研究团队深入挖掘色素光谱变异性,发现藻类色素的多样性通过初级和次级内共生等进化过程形成,揭示了不同藻类谱系的出现与其独特色素组成,展示全光谱流式技术在研究微藻多样性、识别表型光谱特征、检测代谢适应性以及高分辨率单细胞维度分析领域的广泛应用前景。
基于藻胆蛋白的微藻AF指纹
是否表达藻胆蛋白(PBP),是微藻谱系分类的重要标志。作者通过分析来自9个主要微藻类群的32个代表性物种的AF光谱,发现含PBP类群(包括蓝藻、隐藻、红藻和灰藻)与不含PBP类群(如绿藻、硅藻、定鞭藻、裸藻和甲藻)在570–600 nm范围存在显著光谱特征差异,对应于藻蓝蛋白和藻红蛋白的发射峰。并通过定义三个目标光谱区域R1(494–566 nm)、R2(566–647 nm)和R3(647–712 nm)),量化光谱差异,验证含PBP类群在R2区域表现出更高的荧光强度,表明其可作为可靠的分类特征。
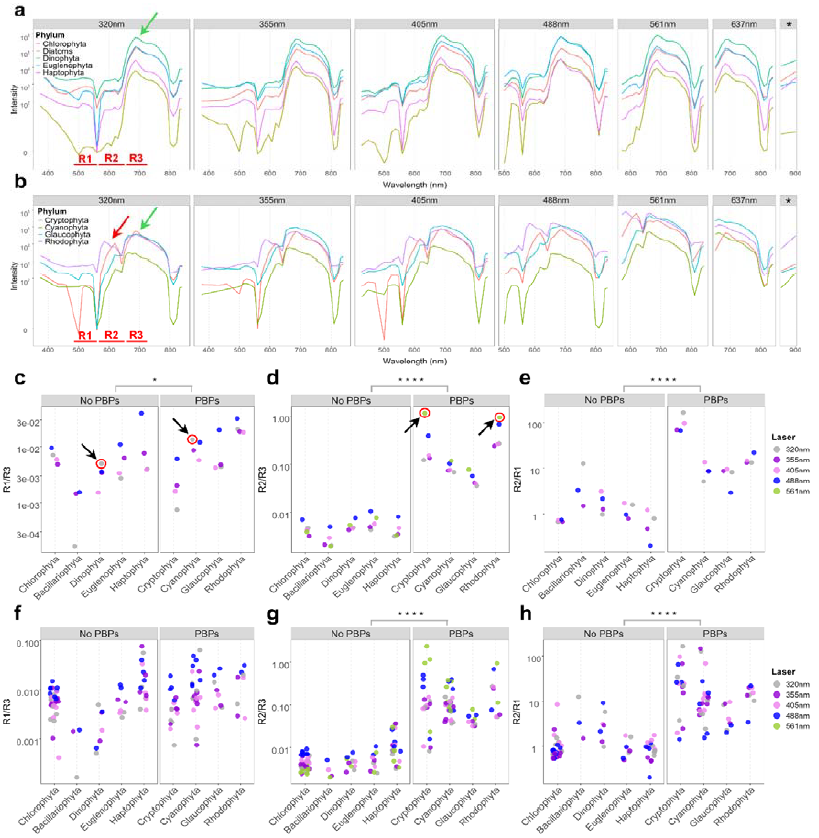
图1. Sony ID7000记录9种微藻类群自发荧光指纹
团藻目群落光谱变异性
利用Sony ID7000多达7激光184荧光通道和360-920nm全波长覆盖的强大光谱检测配置,研究团队聚焦于团藻目(Volvocales),探索了该目下102株在生态和生理特征上具有多样性的微藻物种,发现R1和R2区域CV值显著高于R3区域(图2c);同时PCA结合k-means聚类分析揭示存在三个显著的AF簇,表明团藻目内部在色素组成和AF强度方面存在明显异质性(图2d)。
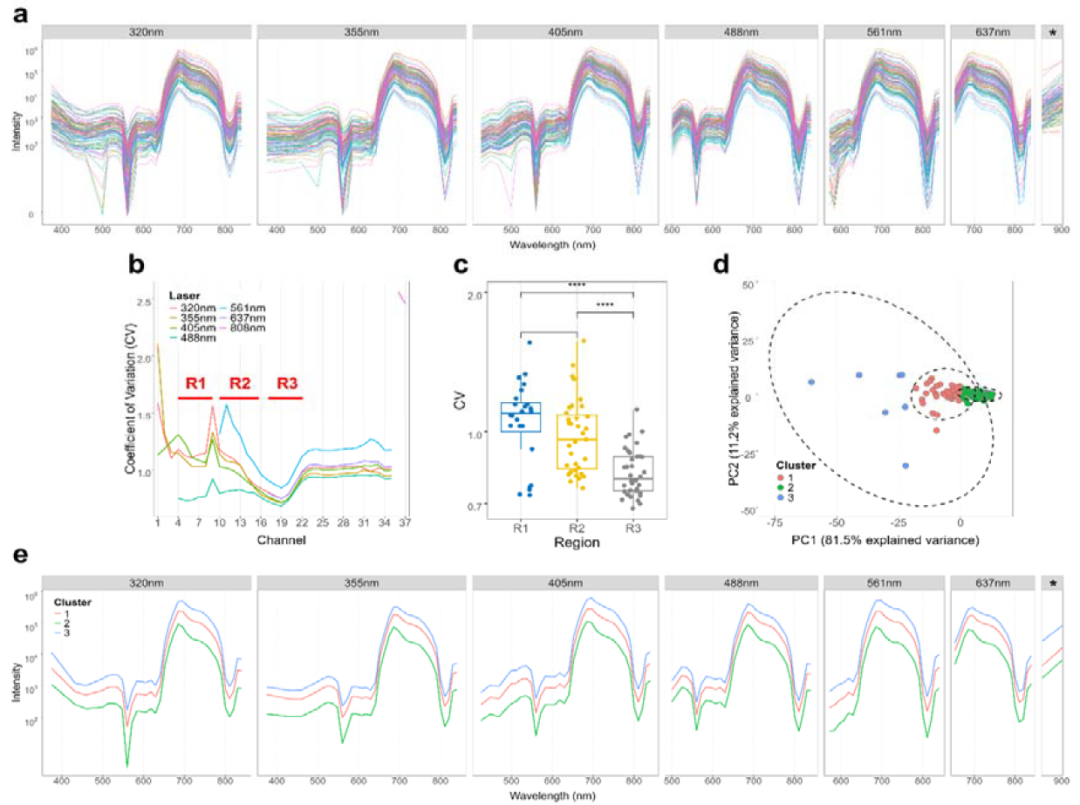
图2. 团藻目102种类群的光谱指纹与信号变异分析
尽管成功识别出团藻目独特聚类,但实验发现即便是单一类群培养,微藻也会表现出显著的AF异质性。作者随后使用索尼MA900多功能流式分选仪对目标类群进行高纯度高效分选,发现单个株系内部存在与细胞生长阶段及凋亡状态相关的不同AF亚群,其共同特征是叶绿素a (Chl a) 荧光强度递减。例如衣藻类群可分辨出5个不同亚群(图3):A1(单细胞)与A2(分裂期细胞)光谱指纹相似;B、C、D亚群Chl a信号逐步减弱,暗示细胞可能处于生理应激状态。
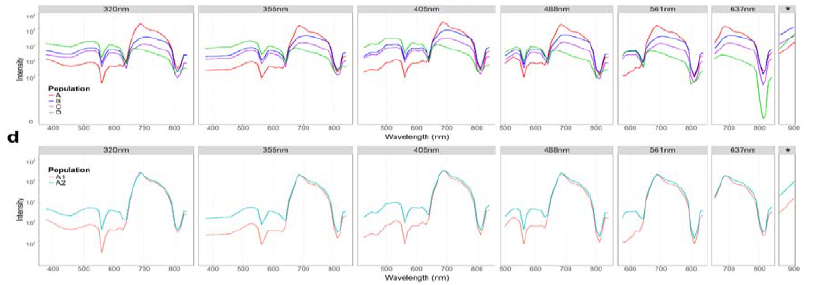
图3. 衣藻群落内各状态亚群光谱分析
基于AF的色素合成与微生物互作监测
为进一步探究AF与生理状态的密切关系,作者分析了红球藻在不同条件下的光谱特征(图4上)。应激组因积累虾青素而呈红色,其光谱指纹虽在355 nm与405 nm激发下也有轻微差异,但561 nm激发下荧光强度显著升高,最能敏感地反映色素状态的转变。
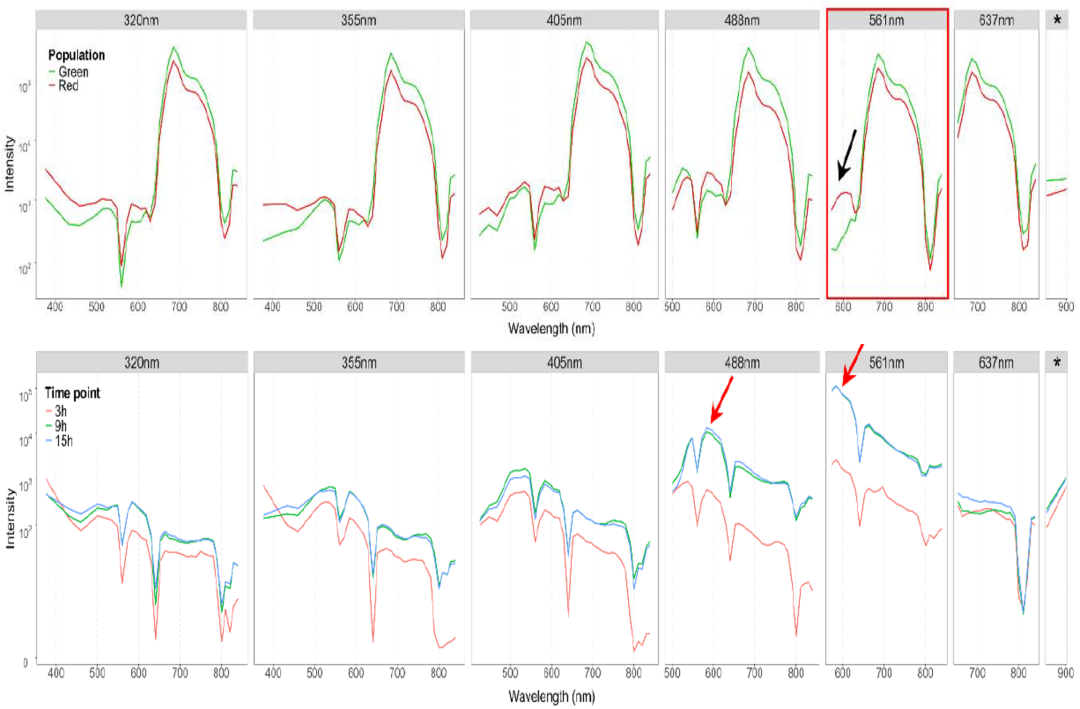
图4. 不同生理状态(上图)以及与细菌互作(下图)状态下微藻光谱特征变化
此外,作者通过监测15小时内微藻-细菌合成群落的时间分辨光谱,发现9 h起光谱指纹出现显著漂移(图4下),证实其合成受特定生长条件诱导,并伴随pH依赖的光谱特性。由此可见,AF可作为一种非侵入式工具,能够实时追踪藻类及细菌中色素的合成与代谢变化。