研究背景
骨骼肌再生过程由肌肉驻留干细胞——肌肉卫星细胞(MuSCs)主导。当肌肉组织受损时,MuSCs能够迅速响应环境信号,被激活进入细胞周期,进而增殖并分化为肌细胞,最终融合形成新的肌纤维。已有研究表明,该过程伴随MuSCs在代谢、转录、翻译及形态结构等方面的多重状态变化,然而MuSCs从静息状态转变为激活状态的具体机制尚不明确。
内容摘要

日本静冈大学研究人员近期发现,离子通道TRPM7通过介导Mg²⁺内流从而触发MuSCs的激活,揭示了肌肉损伤再生过程中的MuSCs激活分子机制,为肌肉再生研究及相关损伤治疗提供了重要的分子机制与潜在介入策略。
研究结果
1. TRPM7缺失导致小鼠肌肉再生障碍
研究者发现TRPM7在MuSCs中高表达,同时损伤环境下MuSCs内Mg²⁺浓度升高。通过注射心脏毒素(CTX)构建小鼠胫前肌损伤模型,作者发现与对照组相比,TRPM7敲除小鼠在损伤后肌肉再生能力显著降低,具体表现为肌纤维横截面积减小、再生肌肉组织重量下降、再生标志物eMyHC表达下调以及Pax7阳性的MuSCs数量减少。
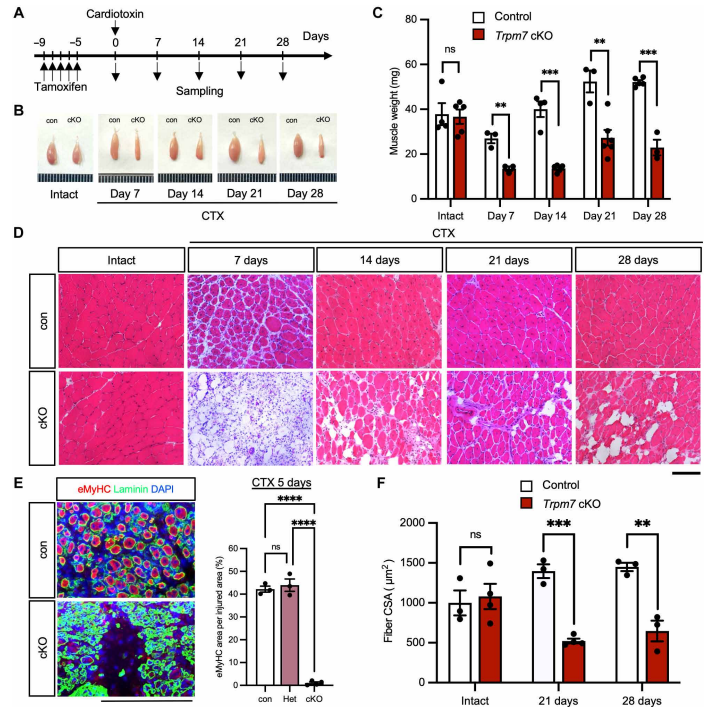
2. TRPM7调控MuSCs细胞周期与肌生成
为进一步探究TRPM7功能,作者使用索尼MA900细胞分选仪分离MuSCs并进行RNA-seq分析。结果显示TRPM7缺失后,细胞周期相关基因(如Cdk1、Cdk4)表达下调,肌生成调控因子(如MyoD、Myog)表达降低,线粒体功能相关基因表达也受损。通过免疫荧光实验进一步检测肌肉再生及细胞周期标志物发现,TRPM7缺失小鼠中MuSCs的Ki67、EdU、Cyclin D及pRb信号显著减弱,表明TRPM7缺失影响了MuSCs的细胞周期进程与增殖能力。
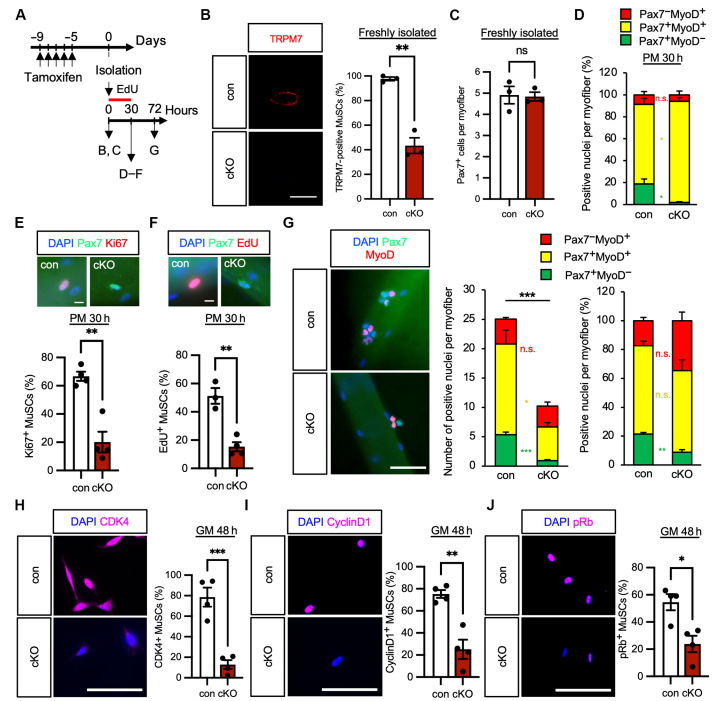
3. TRPM7缺失导致MuSCs激活障碍
静止期突起是未激活MuSCs的典型形态特征,细胞激活后这些突起会回缩。作者通过观察和统计发现TRPM7缺失或Mg²⁺缺乏均导致MuSCs无法正常激活,其静止期突起保留比例显著升高。进一步研究显示,TRPM7缺失还会影响pERK和RhoA的表达,提示TRPM7在MuSCs激活过程中参与调控MAPK信号通路。
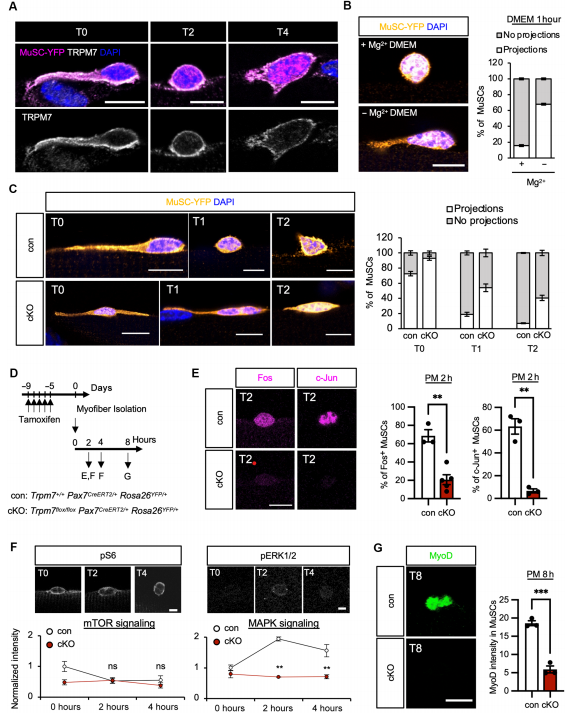
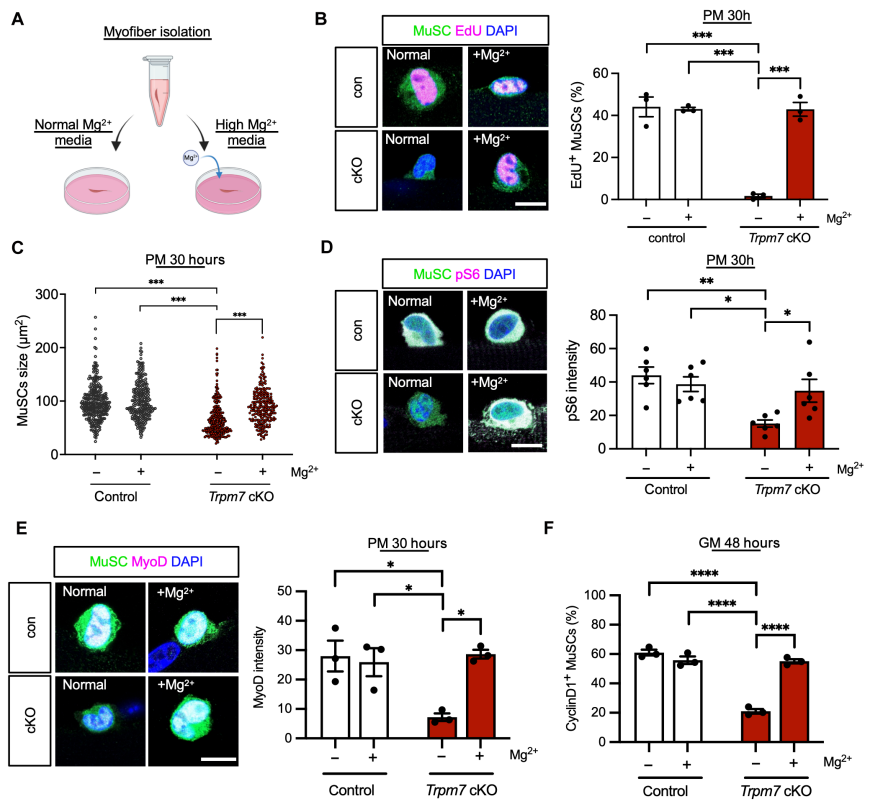
4. Mg²⁺补充可挽救TRPM7缺失表型
为验证TRPM7是否通过Mg²⁺调控MuSCs激活,研究人员对TRPM7敲除小鼠的肌纤维样本进行Mg²⁺补充处理。结果显示,补充Mg²⁺后MuSCs增殖能力显著恢复,EdU阳性细胞数量增加,MyoD和CyclinD1表达水平回升。同时,pS6表达上升,细胞大小恢复正常,表明细胞生长状态得到改善。
研究中MA900分选精彩应用
1. 从肌肉组织中分选MuSCs
本研究基于在体小鼠肌肉损伤模型探索MuSCs的激活机制,从肌肉组织中分离获得高纯度、高活性MuSCs是研究深入的前提和基础。作者使用MA900智能流式分选仪成功分选出高纯度、高活性的MuSCs,用于后续培养及多种标志物检测,从而深入解析细胞功能状态的变化,体现了MA900精确优异的高纯分选和细胞活性保持能力。
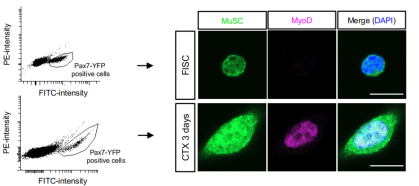
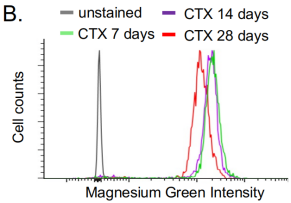
2. 胞内离子浓度检测
作者借助MA900对MuSCs进行锌、钙和镁离子细胞内染色分析,探测MuSCs在损伤激活过程中离子浓度的动态变化,展现了MA900精确且高灵敏度的信号检测与分辨能力。
总结
本研究旨在探索MuSCs在损伤条件下的激活机制。作者发现,TRPM7通过调控Mg²⁺内流触发MuSCs的激活,并影响其后续的细胞周期进程与增殖能力,在肌肉纤维的损伤修复与再生进程中发挥关键作用。该研究为揭示MuSCs激活机制和探索肌肉损伤治疗策略提供了重要数据支持。在研究过程中,MA900凭借其高纯度、高活性的分选性能以及高灵敏度的信号检测分辨能力,为MuSCs相关研究提供了精确可靠的流式分析分选技术保障。