研究背景

食物过敏是生活常见的机体免疫反应,细致观察可以发现一些有趣的现象,比如常对水煮蛋过敏的人群中有些对茶叶蛋不敏感、以及烘焙过的花生比水煮花生更容易致敏。引起上述现象的直接原因是“口服耐受”。
口服耐受(oral tolerance),是宿主对饮食抗原的调控性免疫反应。当食物进入肠道,上皮层附近的递呈细胞(如cDC细胞)将食物的抗原传递给固有层的T细胞,T细胞有Treg细胞或Th细胞两种分化途径。口服耐受依赖于其中的pTreg细胞,抑制不必要的免疫反应。而传统理论认为,cDC细胞是诱导食物抗原特异性的pTreg免疫调控的关键。
主要结论

最近,美国纽约大学医学院的Ranit Kedmi及其团队在Nature发表的文章推翻了该结论,文中指出RORγt APC才是诱导pTreg的关键因素,cDC则负责维持已激活T细胞的活性,参与调节CD8+αβT细胞等。从而构成由RORγt APC、pTreg细胞、cDC1细胞和CD8αβT细胞组成的网络来调控口服耐受。

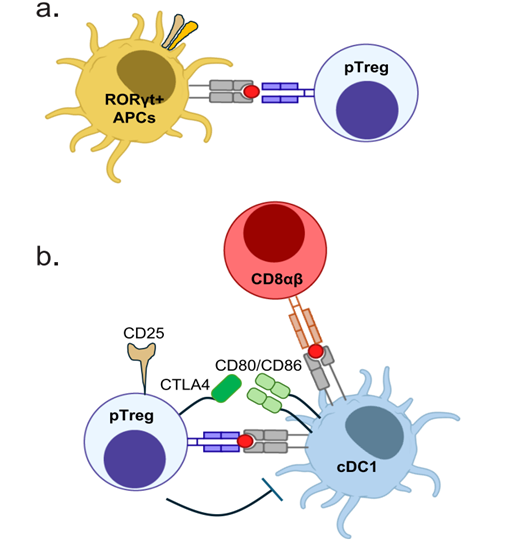
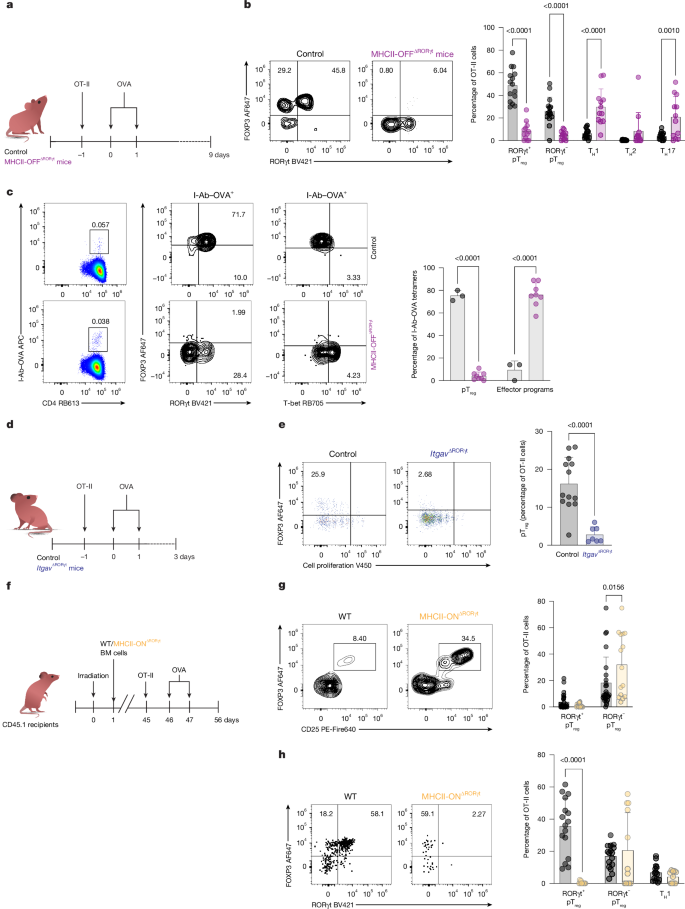
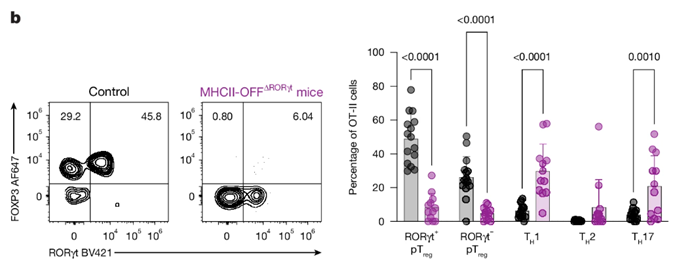
给MHCII-OFFΔRORγt小鼠模型(RORγt无法递呈抗原)口服OVA发现,小肠固有层(SILP)中OVA特异性CD4+T细胞(OT-II)向pTreg的分化完全受阻,但Th1、Th17、Tfh等细胞比例明显升高。而MHCII-ONΔRORγt小鼠模型(仅RORγt递呈抗原)仍然能够有效诱导pTreg。其作用机制为:RORγt APC高水平表达Itgb8基因,该基因编码的整合素ανβ8能激活TGF-β,进而诱导pTreg分化。
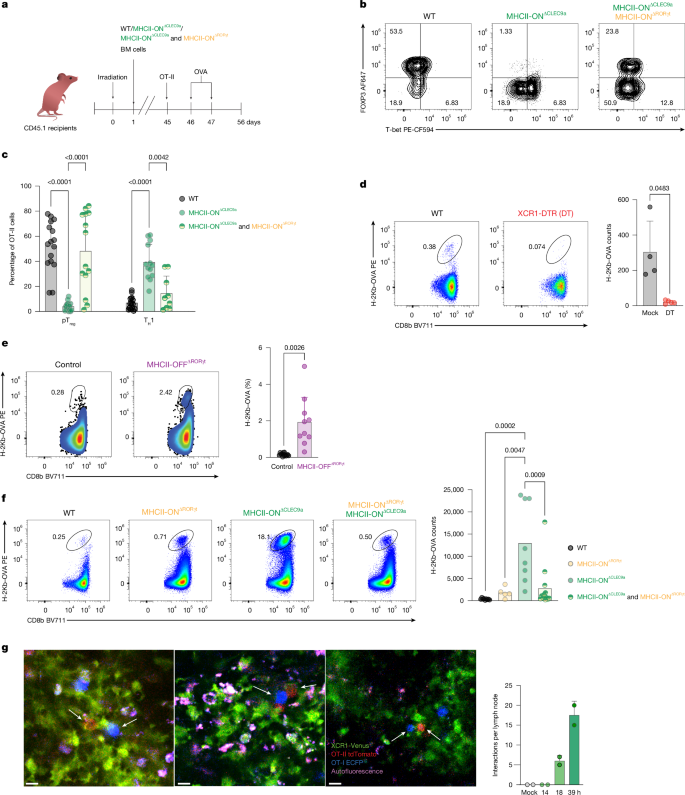
给XCR1-DTR小鼠(清除cDC1)口服OVA后,SILP中食物抗原特异性CD8αβT细胞显著减少,这些CD8αβT细胞表达驻留标志物CD103,不表达效应标志物KLRG1/CD107a,处于 “静息耐受” 状态。此外研究发现,pTreg通过CTLA4 移除cDC1/cDC2表面的CD80/CD86共刺激分子,降低其激活CD8αβ的能力。
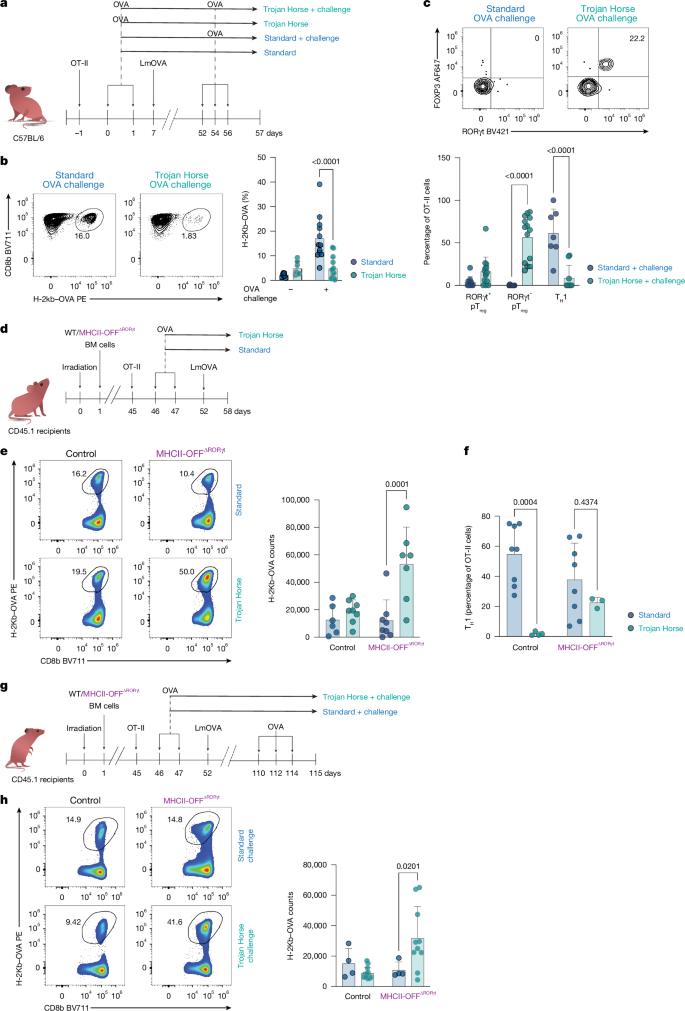
在“特洛伊木马”感染模型(食物抗原与病原体同时出现,如表达OVA的李斯特菌感染)中,CD8αβT细胞扩张并获得效应功能,如分泌细胞因子,可有效清除病原体。感染诱导的炎症环境促进Th1细胞生成,Th1与cDC1互作进一步增强cDC1对CD8αβT细胞的激活能力。感染清除后,再次暴露于食物抗原时,CD8αβT细胞不再扩增,表明耐受机制得以恢复。
MA900在文章中的作用

1. 分选纯化naive抗原特异性T细胞
使用Sony MA900以纯度模式富集抗原特异性naive T细胞并进行过继转移,随后通过流式分析迁移后其分化为pTreg/TH1/TH17 的比例,验证不同APC对T细胞分化的调控作用。这说明通过Sony MA900分选的细胞具有极高的纯度和极佳的细胞活性,确保无其他亚群干扰,同时不影响后续细胞分化。
2. 分选特异性CD8αβT细胞,用于单细胞RNA测序
从小肠固有层(SILP)分离淋巴细胞,用H-2Kb-OVA PE四聚体标记OVA特异性CD8αβT细胞,通过流式分选纯化DAPI-CD19-CD8b+H-2Kb-OVA+细胞,该亚群比例极低,H-2Kb-OVA PE四聚体信号强度偏低。证明了Sony MA900具备极强的弱信号和稀有细胞的分析分选能力。
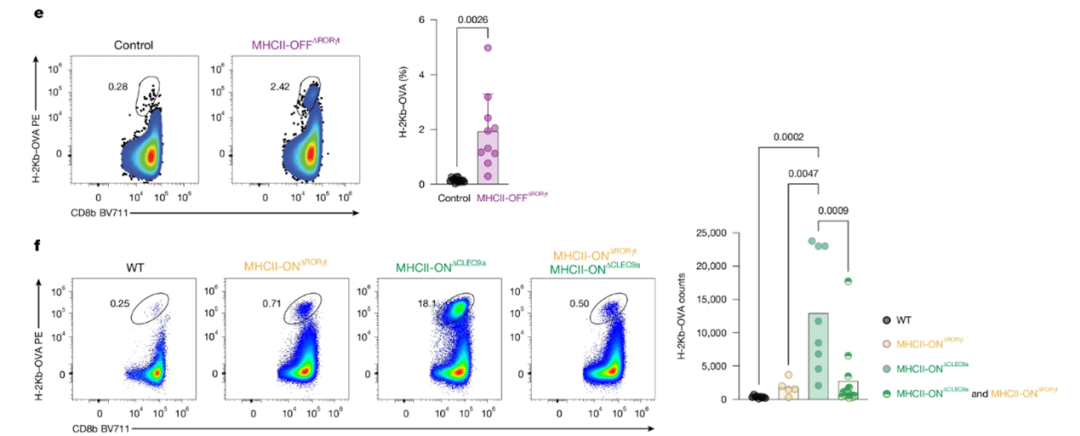
此外,文章中还涉及多种APC细胞分选并与naive OT-II 细胞共培养、Treg分选并回输至小鼠体内等多项涉及细胞分选的实验,这些实验均在Sony MA900上完成,作者依托Sony MA900实现了对多个稀有细胞群体的分型鉴定、高纯度分选和下游功能学验证研究。

本文颠覆了“cDC1诱导食物pTreg” 的传统认知,首次揭示构成口服耐受的核心细胞网络,RORγt APC负责 “启动耐受”,pTreg与cDC1协同 “维持耐受”,感染时 “暂解耐受” 以抗感染,形成动态平衡的机制。为食物过敏、炎症性肠病等疾病提供潜在治疗靶点,为 “诱导耐受同时保留抗感染能力” 的疗法设计提供理论基础。其中,Sony MA900是细胞精细亚型分析分选和分子机制研究的关键支撑。