内容摘要

胰腺导管腺癌(PDAC)是一种预后极差的肿瘤,其发生发展与KRAS基因突变密切相关。近期发表在《Nature Communications》上的一项研究揭示了KRAS驱动的胰腺癌发生过程中,程序性细胞死亡(PCD)的关键调节因子表达上调,使得转分化的细胞处于死亡的边缘。通过转基因小鼠模型构建、原代细胞和类器官培养,以及全自动流式分选技术,研究人员发现TGF-β激活激酶1(TAK1)通过抑制RIPK1介导的凋亡和坏死,防止转分化细胞被清除,从而促进PDAC的发展。这一发现为胰腺癌的预防和治疗提供了新的思路。
1
TAK1缺失抑制KRAS驱动的PDAC发展
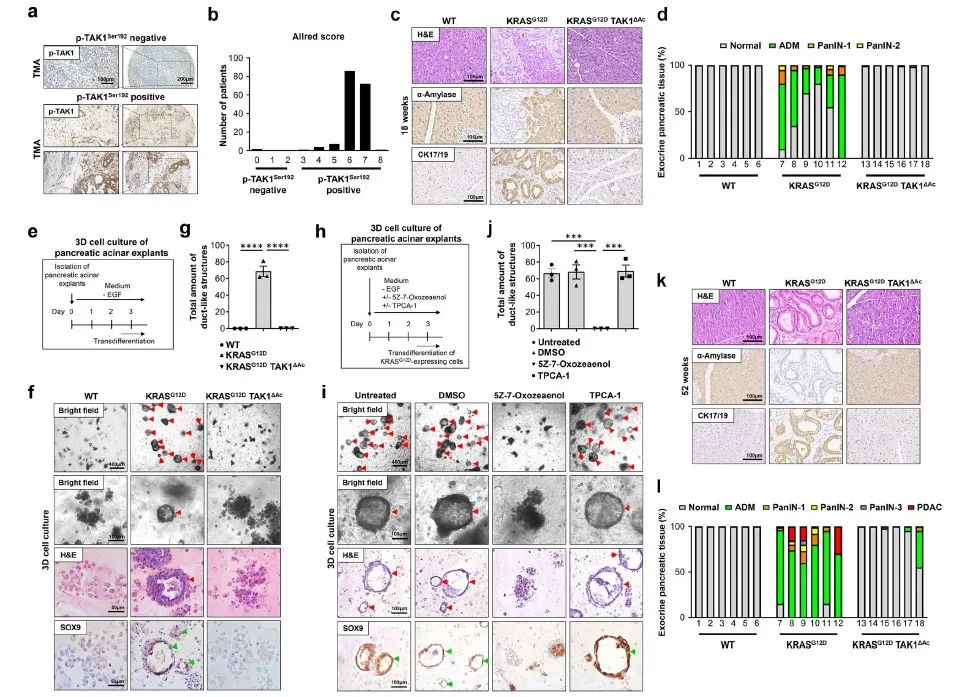
图1. TAK1支持KRASG12D驱动的PDAC发展
研究人员首先通过免疫组化分析了173例人类PDAC样本中TAK1的表达情况,发现癌细胞中TAK1的表达和激活显著上调。随后,作者在18周龄的KRASG12D小鼠胰腺中观察到腺泡-导管化生(ADM)区域和PanIN-1、PanIN-2病变,而在KRASG12D TAK1ΔAc小鼠中,这一过程被完全抑制,表明TAK1在ADM中发挥着关键作用。此外,通过3D胶原基质培养系统模拟体内ADM过程,发现KRASG12D表达的腺泡细胞能够高效地发生ADM并形成导管样结构,而TAK1缺失则阻止了这一过程。
2
TAK1抑制诱导KRAS细胞程序性死亡
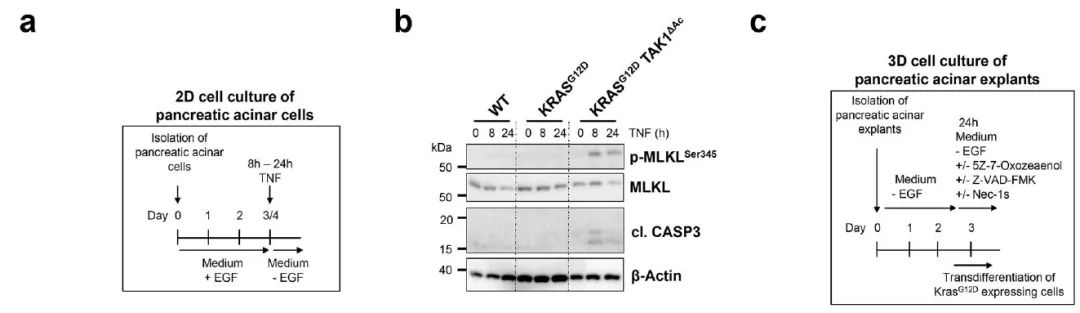
图2. 转分化使腺泡细胞对凋亡和坏死性PCD敏感
为了探究TAK1在KRAS驱动的ADM和癌变过程中的分子机制,研究人员分析了小鼠胰腺蛋白提取物中与MAP激酶信号通路和增殖相关的通路激活情况。结果显示在18周龄KRASG12D小鼠中,AKT、ERK和MEK1/2的磷酸化水平增加,而TAK1的额外缺失则消除了这种增加。进一步的实验表明,TAK1缺失的KRASG12D表达细胞在TNF刺激下显示出CASPASE- 3裂解和MLKL磷酸化,这是凋亡和坏死的标志。
3
TAK1抑制不引发显著免疫反应
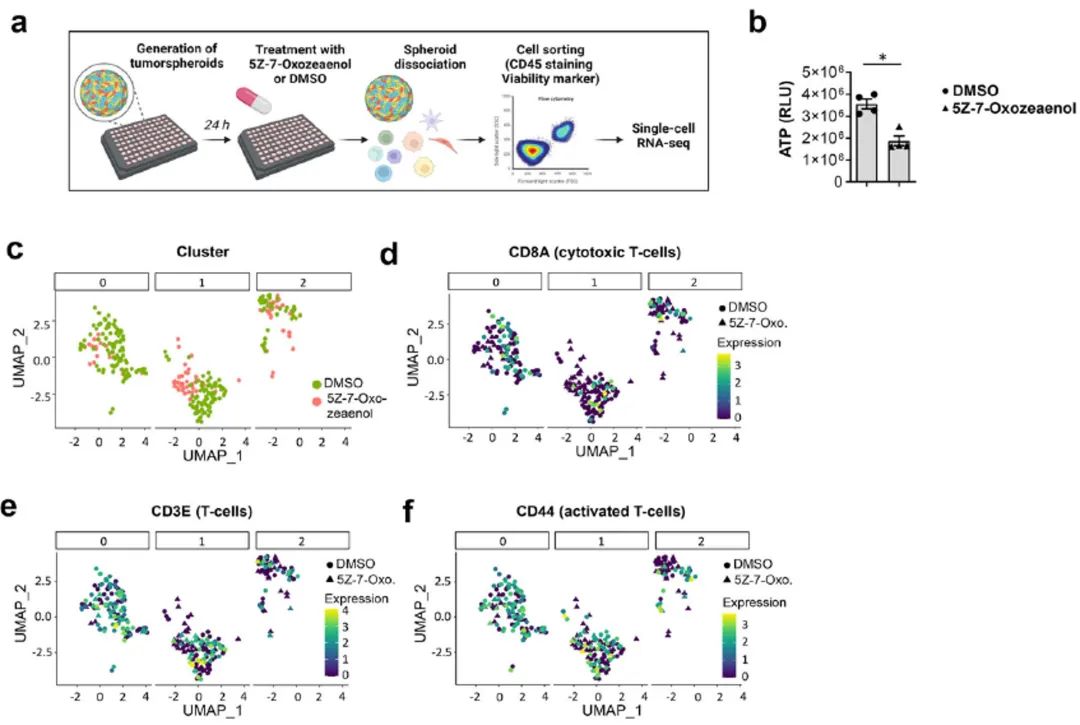
图3. TAK1抑制不会引起促炎免疫反应
研究人员从PDAC患者肿瘤组织中生成了包含肿瘤细胞和免疫细胞的肿瘤球体,并用TAK1抑制剂5Z-7-Oxozeaenol处理,以评估TAK1抑制对肿瘤细胞和免疫细胞的影响。通过Sony SH800流式细胞分选技术,研究人员分离出CD45+免疫细胞,并进行单细胞RNA测序(scRNA-Seq)。结果显示,TAK1抑制主要影响CD8+、CD3E+和CD44+ T细胞,且这些细胞表现出显著的转录组变化。
流式分选关键应用

在本研究中,Sony SH800全自动细胞分选仪发挥了至关重要的作用。研究人员利用SH800从患者来源的肿瘤组织中将CD45+免疫细胞分选至384孔板,为后续的scRNA-Seq分析奠定基础。此外,研究人员还利用SH800细胞分选仪从经过TAK1抑制处理的肿瘤球体中分离出高质量的免疫细胞,并进行了scRNA-Seq分析,进一步证实了TAK1抑制对免疫细胞激活状态的影响。这些发现不仅揭示了TAK1在胰腺癌发展中的复杂作用机制,还为开发新的治疗策略提供了重要的依据。
参考文献:
Schneider AT, Koppe C, Crouchet E. A decision point between transdifferentiation and programmed cell death priming controls KRAS-dependent pancreatic cancer development. Nat Commun. 2025 Feb 19;16(1):1765. doi: 10.1038/s41467-025-56493-7. PMID: 39971907; PMCID: PMC11839950;