儿童多系统炎症综合征(MIS-C)是SARS-CoV-2感染后4-8周出现的罕见但严重的并发症,以全身性过度炎症反应为特征。尽管推测与EB病毒(Epstein-Barr Virus,EBV)再激活有关,但其具体机制尚不明确。
德国儿童青少年健康中心、柏林夏里特医学院等机构合作,通过对四大洲145名MIS-C患儿及221名对照组儿童的免疫细胞图谱分析,揭示了关键致病因素—TGF-β细胞因子和EB病毒再激活。

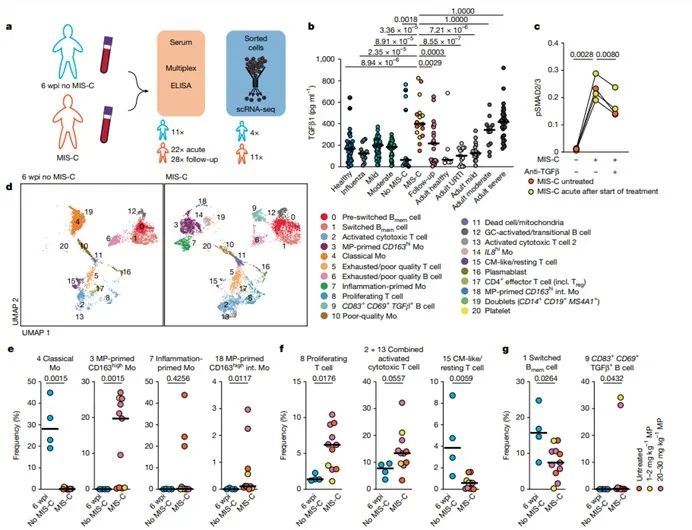
1. TGF-β高表达抑制免疫细胞的功能
作者通过多因子检测、磷酸化分析及单细胞测序等方法发现,MIS-C患儿血清TGF-β1浓度中位数达398 pg/ml,是健康儿童的3倍,与重症COVID-19成人相当。过量的TGF-β抑制免疫细胞功能,如88.6%单核细胞抗原呈递功能显著下调,T细胞抗病毒能力下降(CD69+CD8+细胞减少至1/10)等。
2. TGF-β高表达引起EB病毒再激活
在TGF-β的高表达环境中,特异性识别EBV的TCRVβ21.3+ CD8+T细胞杀伤EBV感染B细胞能力降低16.5%,CD107a脱颗粒标记物降低60%,从而导致EBV感染B细胞裂解周期基因表达量激增2.8倍。EBV激活后感染更多B细胞又刺激更多的TGF-β分泌。(EBV核抗原作为刺激物时,TCRVβ21.3+CD8+ T细胞应答强度是普通T细胞的3.1倍)。
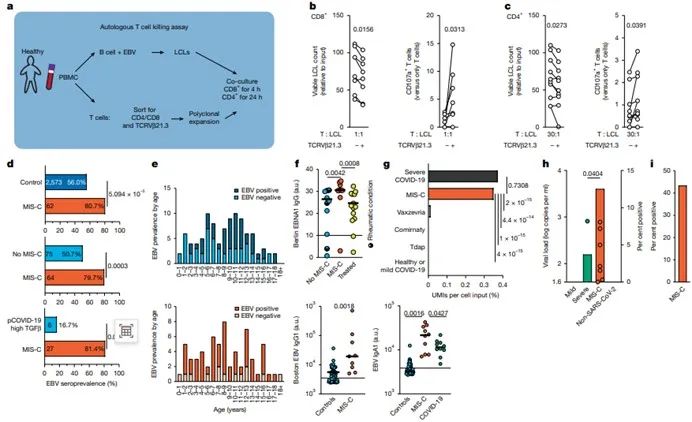
3. TGF-β成为了MIS-C治疗的重要靶点
从上述机制中不难发现,及时检测EBV DNA载量、TCRVβ21.3+ T细胞比例可作为MIS-C预警指标。通过改造EBV特异性T细胞使其抵抗TGF-β的抑制,是很有潜力的细胞治疗方案(目前已在动物实验中展现出保护效力)。
1. 稀有细胞锁定:高速度高纯度高活性分选
• 从复杂PBMC样本中,以高纯度(>98%)精准分选活化型CD38+HLA-DRhigh T细胞亚群。
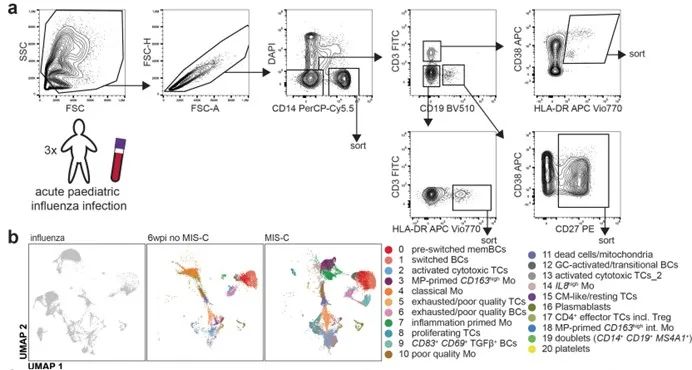
• MA900 以50,000细胞/秒以上的超高分选速度,保证高效快速完成仅占T细胞总数0.9-4.9%的CD4+/CD8+ TCRVβ21.3+效应T细胞亚群的分选,分选后细胞顺利扩增并杀伤EBV感染B细胞(杀伤效率提升14.5-16.5%),证明高速分选同时维持高细胞活性。
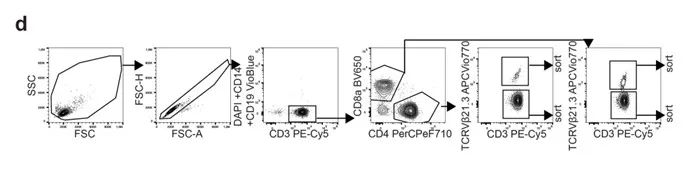
2. 功能实验验证:高参数高灵敏度分析
• MA900 4激光、12检测通道配置,满足对HLA-DR+CD38+T细胞、CD163+单核细胞等多个免疫亚群同时分析。
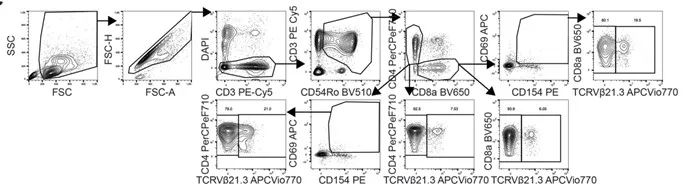
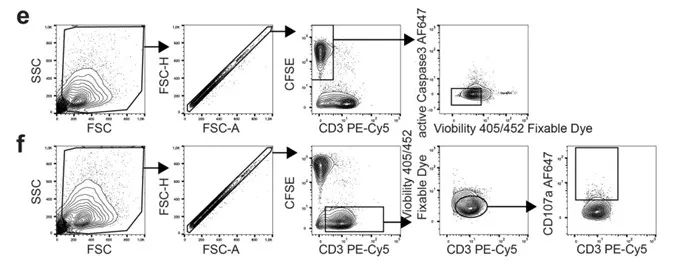
• 检测脱颗粒标志CD107a,揭示TGF-β介导的免疫抑制机制。
总 结
在急性MIS-C样本中,活化的免疫细胞相对脆弱。MA900在快速分选的同时,因其高精度、低损伤的优异性能保障了细胞转录组稳定性,为破解MIS-C的致病机制提供关键技术支撑,再次证明了MA900在生命科学研究中不可替代的价值。