研究背景
系统性递送的脂质体纳米颗粒(LNPs)能将mRNA递送至肝细胞,但递送效率受单核吞噬细胞系统(Mononuclear Phagocyte System, MPS)限制,MPS会清除mRNA-LNPs或使其重新分布至非靶向器官,探究其与巨噬细胞相互作用机制及对转染效率影响对优化递送策略有重要意义。
康奈尔大学研究团队通过暂时性清除循环及组织驻留巨噬细胞(Macrophages,MF),评估对mRNA-LNPs转染效率和生物分布影响。用两种肝靶向 LNPs 制剂证实MF清除可增强肝细胞内靶蛋白表达水平,提高Ai14小鼠模型中CRISPR-Cas9基因编辑效率;进一步研究发现 MF清除会削弱肺靶向和淋巴靶向LNPs制剂的器官特异性递送效率,为阐明LNPs靶向机制提供关键依据。

主要研究内容
1、巨噬细胞清除提高了mRNA-LNPs的肝细胞递送效率
研究人员首先评估脂质体包裹的氯膦酸(LipoD)对小鼠巨噬细胞清除效果以确定mRNA-LNPs最佳给药时间窗,图1显示 LipoD处理24小时后,外周血单核细胞中 CD11b+单核细胞及肝脏 Kupffer 细胞数量显著减少,后续实验选此时间点递送 mRNA-LNPs。编码萤火虫荧光素酶(Fluc)的mRNA检测验证MF清除对mRNA-LNPs转染效率的提升作用,结果显示MF清除组小鼠肝脏区域Fluc表达信号较对照组显著增强,且MF清除可促进肝实质细胞对mRNA-LNPs的摄取效率。
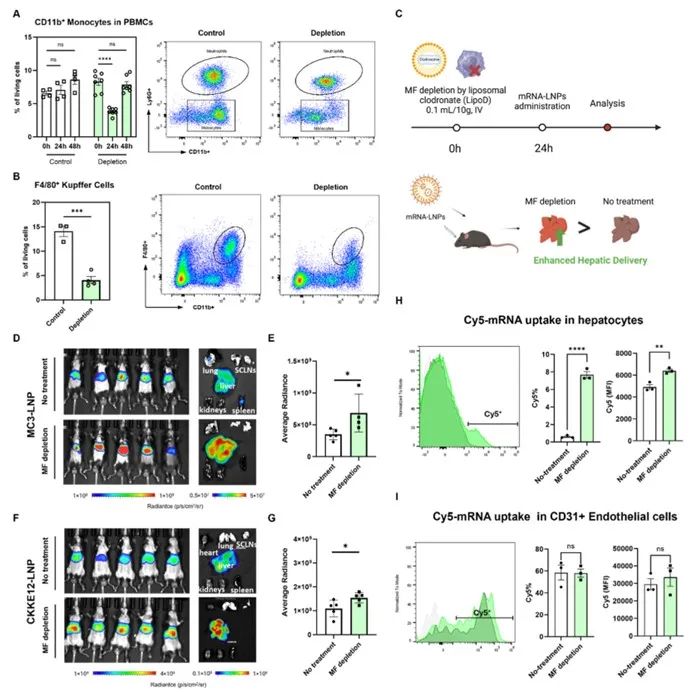
图1 巨噬细胞清除提高mRNA-LNPs的肝细胞递送效率
2、MF清除提高了基于mRNA-LNPs的体内基因编辑效率
将Cas9 mRNA和sgRNA封装于CKK-E12-LNP脂质体中,经静脉注射递送至MF清除的Ai14小鼠体内,研究MF清除对mRNA-LNPs介导的体内基因编辑效率的影响(图2)。结果显示,MF清除小鼠肝细胞中tdTomato阳性率较对照组显著提高,肝组织切片也证实该结果。且PCR检测表明MF清除组小鼠肝细胞内目标基因的编辑效率达50%,对照组仅为21%。由此证明,不增加LNP剂量时,MF清除也可显著增强mRNA-LNPs的体内基因编辑效率。
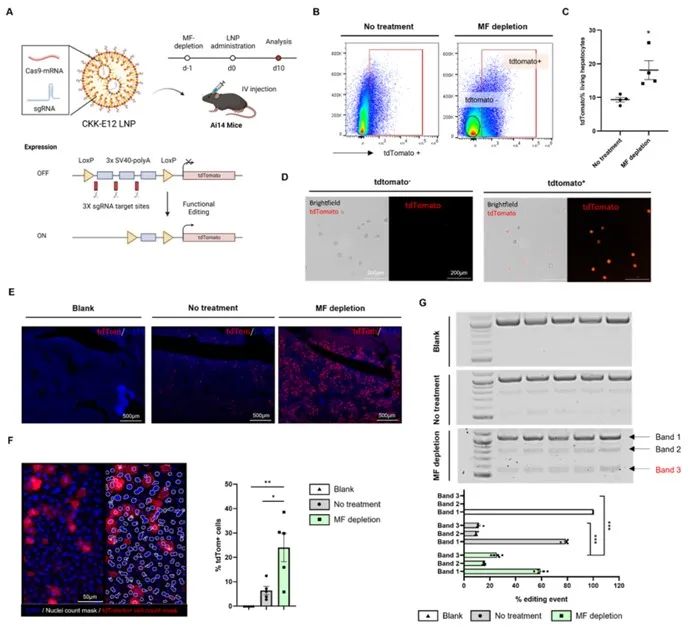
图2 巨噬细胞的清除增强了肝细胞内基于mRNA-LNPs的CRISPR/Cas9基因编辑效率
3、MF清除介导了非肝细胞亲和的mRNA-LNPs的生物分布
研究人员在MC3脂质体中加阳离子DDAB制肺亲和性脂质体制剂,向MF清除小鼠递送携带Fluc mRNA的LNPs并测其生物分布。结果显示MF清除组小鼠肝脏、脾脏Fluc表达显著增加,肺部分布比例从对照组89.37%降至MF清除组 15.75%(图 3)。进一步分析Cy5标记LNPs在肝细胞摄取情况,发现肝实质细胞(非内皮细胞)的Cy5阳性细胞比例及平均荧光强度均显著升高,表明MF清除促进肝细胞对 LNPs摄取,也解释了MF清除后肺亲和性脂质体制剂在肝脏中mRNA表达增强的原因。
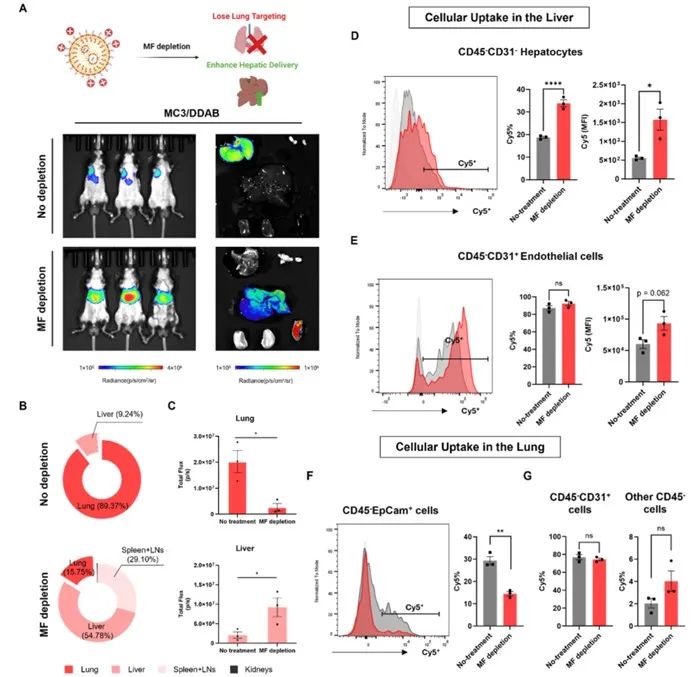
图3 巨噬细胞清除可消除带正电LNPs的肺靶向递送

索尼流式在研究中的工作
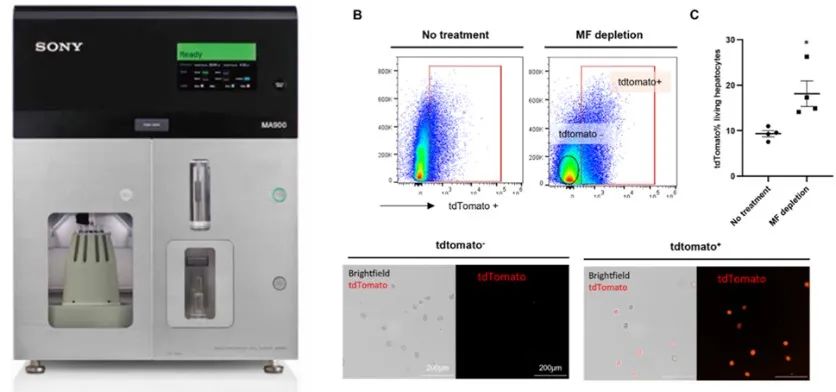
研究人员采用SONY MA900流式细胞仪系统分析了Ai14小鼠模型中tdTomato阳性肝细胞的比例变化,定量评估巨噬细胞清除对基因编辑效率的影响。结果显示巨噬细胞清除后tdTomato阳性肝细胞比例显著提高(p<0.05)。随后研究人员通过SONY MA900流式分选技术高活性、高效率分离tdTomato阳性细胞用于进一步验证编辑效果,直观展示了基因编辑后的细胞表型变化。
SONY全自动分选仪MA900具有较高的全自动校准和高稳定性,其微流控芯片技术和标配半导体金属温控分选系统给研究者提供高活性、高纯度、高效率的分选效果,同时一键式可更换上样系统,有效避免样本间交叉污染的风险,满足不同样本间的的分析和分选要求。

Reference:
ACS Nano.. 2025 Apr 15;19(14):14422-14433..Yuan Z, Luozhong S, et al. Transient Macrophage Depletion Circumvents Scavenging and Redirects Biodistribution of mRNA-Lipid Nanoparticles. ACS Nano. 2025 Apr 15;19(14):14422-14433. doi: 10.1021/acsnano.5c02001. Epub 2025 Apr 1.