内容摘要

90%以上晚期胃癌(GC)属于微卫星稳定型(MSS),对免疫检查点抑制剂(ICI)的响应率仅10%,远低于微卫星不稳定型(MSI-H)胃癌(45-60%)。近期中国医科大学附属第一医院刘云鹏团队在 《Nature Communications》杂志上发表了研究论文“T-bet+CD8+ T cells govern anti-PD-1 responses in microsatellite-stable gastric cancers”,旨在解决MSS胃癌的ICI治疗瓶颈,通过多组学分析揭示关键免疫细胞亚群的作用机制,并开发预测模型筛选潜在获益患者。
主要内容
1. 机器学习精准分层患者
利用半监督学习(PUL算法)整合28种免疫细胞丰度和4872条免疫通路活性特征,构建预测模型(AUC=0.924),成功识别19.37%的MSS胃癌潜在ICI响应者(MSS-PRs),该群体具有与MSI-H胃癌相似的炎性肿瘤微环境(TME)。
2. T-bet⁺CD8⁺T细胞的核心作用
与T-bet-CD8+ T细胞相比,作者发现T-bet+CD8+ T细胞在ICI敏感型胃癌的肿瘤区域高度浸润,并表现出更强的抗肿瘤活性。研究中团队采用Sony SA3800同步检测T细胞亚群的表面标志物(CD4/CD8/CXCR3)、转录因子(T-bet)及功能性分子(IFN-γ、GZMB),精准区分T-bet⁺CD8⁺T细胞及其效应表型。单细胞RNA测序也证实,T-bet+CD8+ T细胞表达较高水平的IFN-γ、GZMB和CXCR3,综合证据表明T-bet+CD8+ T具备更强的抗肿瘤免疫能力。
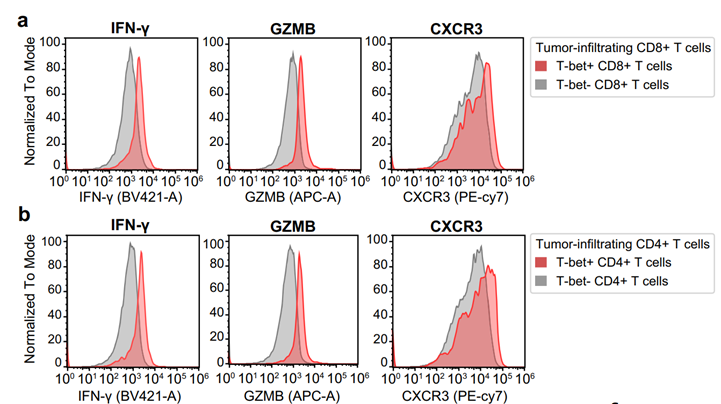
图1. 流式分析IFN-γ, GZMB, CXCR3在肿瘤浸润T细胞中的表达
3. 过继细胞疗法的突破
研究人员构建了人源化小鼠模型,通过mIHC和Sony SA3800全光谱流式分析技术检测证明了T-bet high T细胞转移小鼠的TME中富含T-bet+CD8+和T-bet+CD4+ T细胞,抗PD-1抗体与同型对照相比使肿瘤体积缩小68.3%(对照组45.2%);而T-bet low T细胞转移的小鼠仍保持免疫逃逸状态,表明T-bet high T细胞转移联合抗PD-1抗体显著增加了小鼠肿瘤核心的免疫浸润。
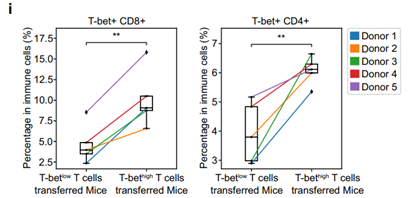
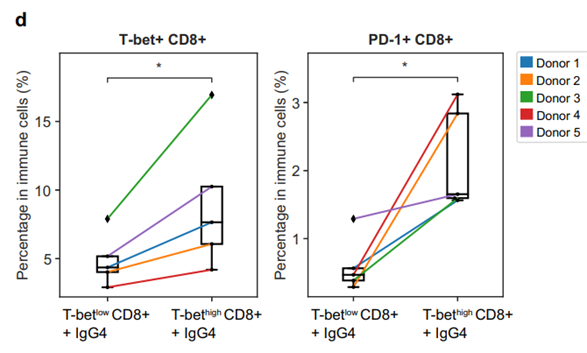
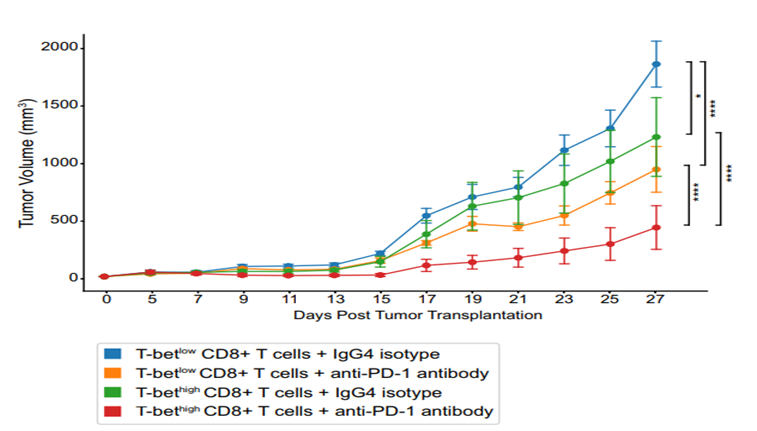
图2. T-bet high T细胞增加了小鼠肿瘤核心的免疫浸润
4. T-bet+ T细胞和PD-L1+肿瘤细胞之间存在正反馈回路
对ICI应答者和MSS-PR患者进行空间转录组分析,发现从T-bet+/PD-L1+微区域的边缘到中心,多种基因(如IDO1、CXCL9/10/11、IFNG、GZMB等)的表达水平持续增加,形成趋化T-bet+ T细胞迁移的梯度,并证实T-bet+CD8+ T细胞对肿瘤细胞的趋化性由IFN-γ调控。
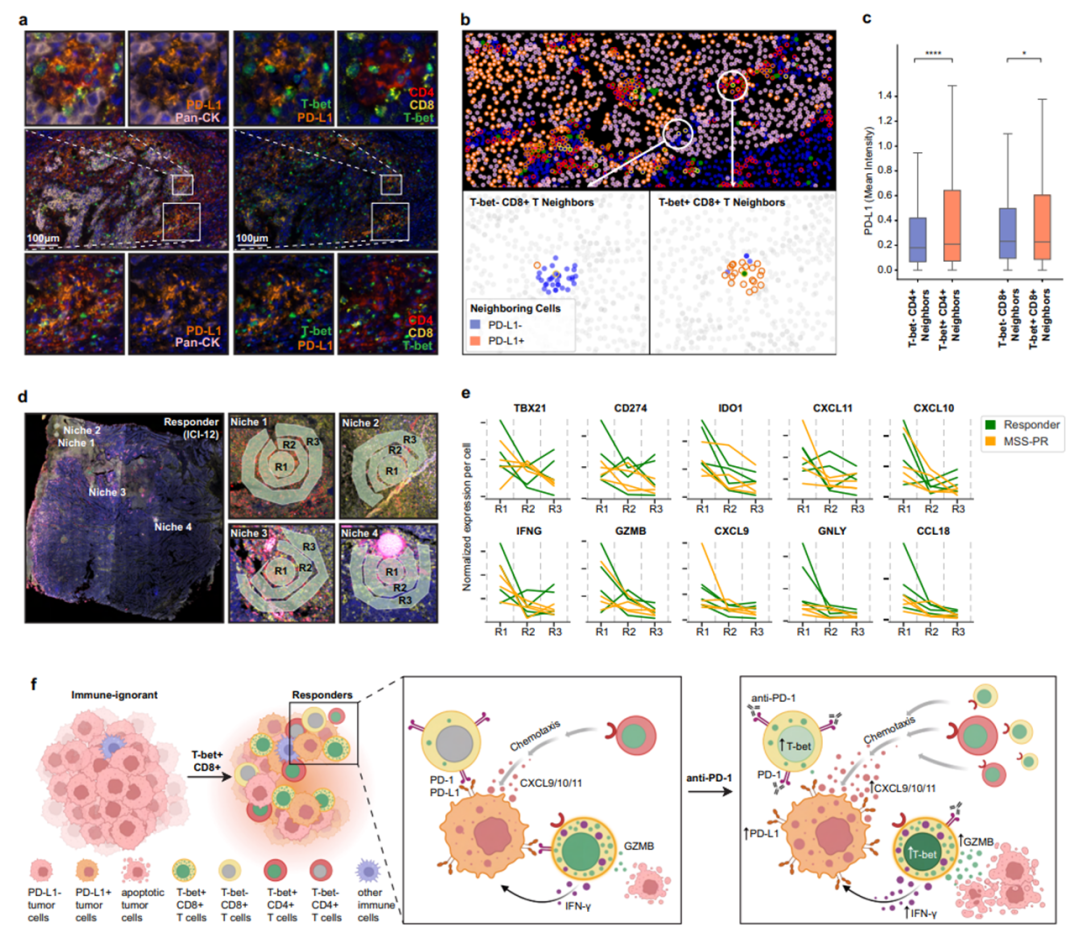
图3. T-bet+T细胞与PD-L1+肿瘤细胞之间的正反馈回路驱动ICI易感性
索尼流式亮点
本文研究中涉及的流式实验均采用索尼SA3800光谱流式细胞仪完成关键性验证。SA3800采用索尼专利领先的全光谱检测和分析技术,实现真实且完整的全光谱荧光信号无瑕检测;同时应用专利光谱解析方法,拆分荧光信号,无需调节补偿;且具备参照光谱库,可随时反复调用参照光谱,无需反复做单染管。该研究流式实验复杂多样:涉及人/鼠多物种样本,涉及多种类型的样本处理方式,需进行表面和胞内蛋白以及细胞因子检测,SA3800的专利前沿设计不仅为其提供客观准确的流式数据,参照光谱库的灵活调用还助力其高效检测多种样本类型,显著提升科研效率与科研产出。
总结
本研究首次确立T-bet⁺CD8⁺T细胞作为MSS胃癌ICI治疗的关键效应细胞和预测标志物,索尼SA3800的高维分析能力为机制解析提供了不可替代的技术支撑。其应用不仅推动个体化治疗策略(如基于PUL评分或T-bet⁺细胞浸润水平筛选患者),更为过继细胞疗法联合ICI的临床转化奠定基础。
参考文献:
Tang S, Che X, Wang J, Li C, He X, Hou K, Zhang X, Guo J, Yang B, Li D, Cao L, Qu X, Wang Z, Liu Y. T-bet+CD8+ T cells govern anti-PD-1 responses in microsatellite-stable gastric cancers. Nat Commun. 2025 Apr 25;16(1):3905. doi: 10.1038/s41467-025-58958-1. PMID: 40280928; PMCID: PMC12032036.