
中枢神经系统中,胶质细胞在维持稳态、信号传导及损伤修复中发挥核心作用。然而,其恶性转化形成的胶质瘤,尤以胶质母细胞瘤(GBM)为代表,因其高度异质性、侵袭性强及治疗耐受性,仍是神经肿瘤领域的重大挑战。
深入解析胶质细胞生理功能及其向肿瘤转化的复杂分子机制,并据此开发高效靶向药物,是突破当前诊疗瓶颈的关键。传统研究方法在通量、多参数同步分析及捕捉动态异质性方面存在局限。高内涵筛选(High-Content Screening, HCS)系统作为一项集成自动化显微成像与先进图像分析的前沿平台,以其高通量、高分辨率、多靶点、多维度的优势,为上述研究提供了革命性工具。本文聚焦高通量筛选及数据挖掘,探索胶质细胞的机制研究,解析其在破解胶质瘤治疗困境中的前沿进展与转化潜力。
在临床阶段,研究者发现儿童和成人的高级别胶质瘤患者中存在非增殖状态且表达 Prominin-1(PROM1,也称为 CD133)的恶性细胞群。研究人员使用基因工具可视化追踪和消融小鼠脑癌和人类癌症类器官中的静息细胞(Quiescent cells),揭示了它们位于肿瘤核心和边缘,并证明静息细胞参与脑癌细胞的浸润。研究人员还发现 DYRK1A/B 抑制剂去氢骆驼蓬碱(Harmine)可部分减少静息和浸润癌细胞的数量,研究结果揭示了静息细胞亚群可能是导致高级别胶质瘤侵袭性的部分原因。本研究中,研究人员建立了人类脑瘤的类器官模型,并且证明了在该模型中也能跟踪静息态肿瘤细胞。
在本研究中,研究者使用了 Molecular Devices 公司的 ImageXpress Micro Confocal 共聚焦高内涵成像分析系统结合类器官模型,筛选可以清除静息态肿瘤细胞的药物。结果表明 DYRK1A/B 抑制剂去氢骆驼蓬碱清除静息细胞的效果最好,也可以降低肿瘤类器官的侵入性,后期或许可以尝试作为浸润性高级别神经胶质瘤的治疗药物。
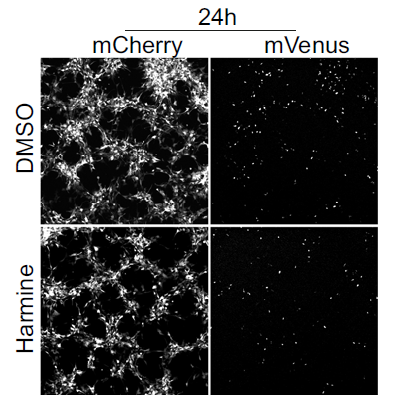
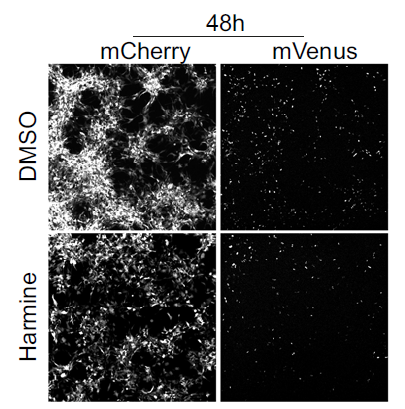
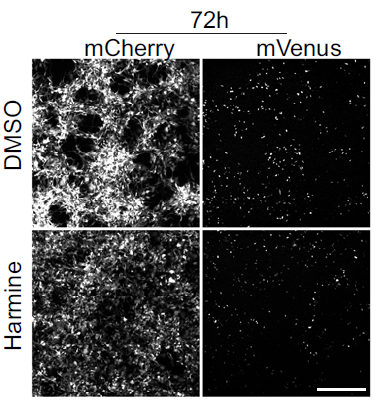
不同药物组处理(DMSO, Harmine)后 24 小时、48 小时和 72 小时的细胞图像(每种情况 n=54 张图像)
在神经发生过程中,脑内皮细胞通过为神经祖细胞提供营养支持从而发挥关键作用。本研究发现中风后的雄性小鼠中将星形胶质细胞转化为神经祖细胞,推测大脑内皮细胞可能会释放转分化信号。研究者发现,在氧糖剥夺(Oxygen-Glucose Deprivation, OGD)后,脑内皮细胞释放含有促神经因子 Ascll 的微泡,这些微泡进入星形胶质细胞以诱导其转分化为神经祖细胞。在局灶性脑缺血的小鼠模型中,Ascll 在星形胶质细胞转化为神经祖细胞之前在内皮细胞中被上调。注射脑内皮衍生的微泡会放大星形胶质细胞转分化的过程。内皮特异性过表达 Ascll 增加星形胶质细胞向神经祖细胞的局部转化并改善行为恢复。该研究结果显示了一种意想不到的神经可塑性血管调节机制,这可能为改善中风后的预后开辟治疗机会。
本研究使用 Molecular Devices 公司的 ImageXpress 高内涵成像分析系统进行钙成像的拍摄。在钙成像 5 天前,使用 hSyn.GCaMP6s AAV 或 pHAGE-RSV-GCaMP6s 慢病毒转染细胞。在初始微囊泡处理后 18 至 21 天之间,在宽场模式下对转化后的细胞进行成像。钙成像实验结果表明转分化细胞中的活性类似于“阳性对照”神经元中的活性,并且这些钙反应可以被河豚毒素(TTX)治疗阻断。
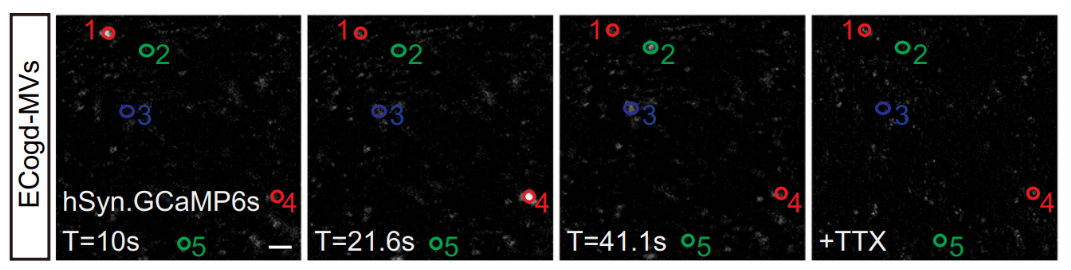
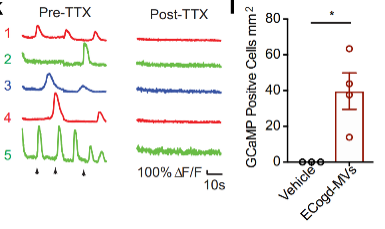
使用 1 μM 河豚毒素(TTX)处理用 hSyn.GCaMP6S AAV 转染后的转化细胞。左图为标注的 GCaMP6s 信号的 1-5 个感兴趣区域。右图表示使用载体或 ECogd-MV 处理的 AC 中 GCaMP+ 细胞的数量
髓母细胞瘤(MB)和高度胶质瘤(HGG)是儿童时期最具侵袭性和最常见的致死性实体肿瘤。来源于人类诱导多能干细胞(hiPSCs)的脑类器官已被证明是模拟脑部癌症的良好体外模型。脑肿瘤类器官与脑健康类器官的共培养体系很好地模拟了脑部肿瘤在正常组织中的转移和侵袭过程,搭配活细胞共聚焦成像系统,能够帮助探索转基因类器官的适用性,以及特异性地分析哪些癌细胞参与了原位移植后 MB 和 HGG 的扩散。本研究利用 hiPSCs 定向诱导小脑和前脑类器官,并通过分析患者病灶中的过表达基因,通过培养过表达特异性基因的肿瘤类器官来模拟病理发生过程。本研究还进行了胶质瘤类器官原位移植和共培养实验,进行细胞起源的谱系追踪和药物筛选。本研究以更精确和定制的方式进行,在体外利用类器官共培养模型进行谱系追踪和药物筛选实验。本研究的模型体系及研究方法为体外和体内的髓母细胞瘤和高级胶质瘤研究提供了新的思路。
本研究使用 Molecular Devices 公司的 ImageXpress Micro Confocal 共聚焦高内涵细胞成像分析系统进行活体类器官药物筛选的成像。从第 0 天开始对药物处理后的 HGG 类器官进行实时成像,然后在所需的时间点(例如,药物处理的第 3 天和第 7 天)使用配备温度/ CO2 控制的 ImageXpress 共聚焦高内涵细胞成像分析系统进行实时成像。为了对整个类器官成像,首先使用 2x Plan Apo 物镜在宽场模式下进行采集,使用 QuickID 程序定位类器官的中心。然后在共聚焦模式下使用 4x Plan Apo 物镜,拍摄 z 序列。

胶质母细胞瘤作为中枢神经系统恶性程度最高的脑肿瘤(WHO IV 级),其固有的放疗抵抗机制始终是临床治疗的核心挑战,这也是许多患者出现复发及放疗失败的主要原因。之前的工作表明,细胞衰老过程与肿瘤细胞的治疗抗性存在密切关联,而这一领域的突破正为破解放疗耐受难题提供全新思路。本研究首次证实了细胞衰老相关基因 IFI16 在胶质母细胞瘤中通过激活铁死亡调控因子 HMOX1 的转录程序,形成抑制铁死亡-增强辐射抵抗的关键信号轴。结果显示,IFI16 通过与转录因子 JUND 和 SP1 的协同互作,驱动 HMOX1 基因的表观遗传激活,进而通过抑制辐射诱导的脂质过氧化级联反应,阻断铁死亡执行进程。另外,本研究使用经典降糖药物格列本脲可特异性靶向 IFI16 的 pyrin 结构域,通过干扰其介导的细胞衰老样表型,显著增强肿瘤细胞对辐射的敏感性。该研究不仅揭示了 IFI16-HMOX1 信号轴在胶质母细胞瘤放疗抵抗中的核心调控作用,更通过靶向 IFI16 的药物重定位策略,为临床克服放疗耐药提供了兼具理论创新性与转化潜力的治疗新范式。
本研究使用 Molecular Devices 公司的 ImageXpress Micro 4 高内涵成像系统进行图像筛选及分析。对胶质母细胞瘤细胞进行免疫荧光染色检测,包括细胞贴壁或辐照后不同时间点的固定,透膜及封闭处理,使用抗 Ki67 或抗 IFI16 一抗结合 Alexa Fluor 555 标记二抗进行荧光标记,使用 DAPI 染色细胞核,通过软件颗粒度分析功能定量细胞内荧光斑点,从细胞水平分析 IFI16 等蛋白的表达定位及辐照后的动态变化,为探究 IFI16 介导的铁死亡逃避和辐射抵抗机制提供可视化数据支撑。
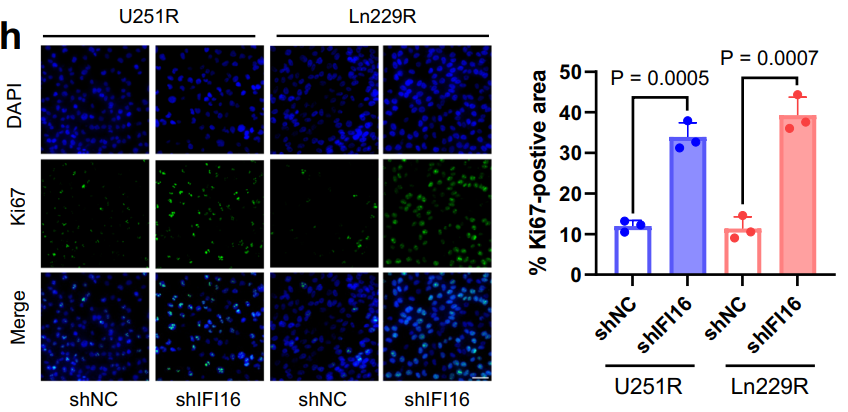
对敲低 IFI16 的 U251R 和 Ln229R 细胞进行 Ki67 表达及 Ki67 阳性区域的免疫荧光分析(n=3)。比例尺=20 μm
参考文献
1. Antonica F, Santomaso L, Pernici D, et,al. A slow-cycling/quiescent cells subpopulation is involved in glioma invasiveness. Nat Commun. 2022 Aug 15;13(1):4767.
2. Li W, Mandeville ET, Durán-Laforet V, Moro MA, Lo EH, et.al. Endothelial cells regulate astrocyte to neural progenitor cell trans-differentiation in a mouse model of stroke. Nat Commun. 2022 Dec 19;13(1):7812.
3. Lago C, Gianesello M, Santomaso L, Tiberi L, et.al. Medulloblastoma and high-grade glioma organoids for drug screening, lineage tracing, co-culture and in vivo assay. Nat Protoc. 2023 Jul;18(7):2143-2180.
4. Zhou Y, Zeng L, Cai L, Shao C, et.al. Cellular senescence-associated gene IFI16 promotes HMOX1-dependent evasion of ferroptosis and radioresistance in glioblastoma. Nat Commun. 2025 Jan 31;16(1):1212.
