
药敏检测,全称“药物敏感性检测”,是评估患者个体对药物反应的关键技术。在癌症治疗中,它如同“体外战场”,提前测试哪种药物能精准杀伤肿瘤细胞,从而制定个性化方案。但是,传统的二维细胞系无法模仿体内肿瘤的必需 3D 细胞组成和异质性,导致新型药物开发的成功率小于 1%。
随着精准医疗的兴起,类器官药敏检测 (Organoidbased Drug Sensitivity Testing, DST) 成为破局转折点——它通过体外构建患者肿瘤的“微型替身”,模拟药物反应,可为个体化治疗提供科学依据。
核心趋势:
标准化进程加速:2024 年陈晔光院士团队发布全球首个类器官药敏检测专家共识,推动技术从实验室迈向临床[1]。
监管认可突破:FDA 首次基于类器官数据直接批准 Sutimlimab 临床试验,标志其在新药开发中的权威性[2]。
临床转化提速:中国多家三甲医院已开展类器官指导的个体化治疗临床试验,覆盖肺癌、结直肠癌等 10 余种癌种。
① 高度模拟患者肿瘤特征
类器官由患者肿瘤组织直接培养而成,能够保留原始肿瘤的基因突变、分子特征及空间结构。比传统 2D 细胞培养更接近真实生物学行为,反映肿瘤的异质性和复杂性。通过共培养技术(如免疫细胞、基质细胞),类器官可部分模拟肿瘤微环境,用于评估免疫治疗(如 PD1/PDL1 抑制剂、CART)的疗效。
② 个体化医疗预测
多项研究表明,类器官药敏检测结果与患者实际临床疗效高度一致。例如:在转移性胃肠道癌中,类器官预测化疗反应的敏感性和特异性分别达 100% 和 93%[3]。肺癌类器官预测化疗和靶向治疗的敏感性与临床结果吻合度达 84%[4]。因此,通过筛选患者类器官对不同药物(化疗、靶向、免疫治疗)的反应,可为个体化治疗提供依据,减少无效治疗和副作用。
③ 加速新药研发
类器官生物样本库支持大规模药物筛选,发现新药或拓展现有药物适应症,大大缩短新药研发周期。通过原发耐药或诱导耐药类器官模型,揭示药物作用机制 (MOA) 和耐药机制 (MOR) 。
④ 临床转化潜力
类器官可评估传统化疗药物及放疗敏感性,例如直肠癌类器官成功预测新辅助放化疗反应[5]。通过基因编辑(如 CRISPR/Cas9)验证靶点,筛选针对特定突变(如 EGFR、ALK)的靶向药物。类器官与免疫细胞共培养模型可用于测试免疫检查点抑制剂、CART 等疗效,保留肿瘤相关抗原的表达特征。除手术样本外,液体活检(血液、胸腹水)也可培养类器官,动态监测治疗反应,缩短药物开发周期。同时,类器官模型被 FDA 认可为临床前研究工具(如 Sutimlimab 的快速审批),加速药物从实验室到临床的转化[6]。
⑤ 替代传统模型的局限性
传统 2D 细胞系无法模拟肿瘤三维结构和异质性,类器官填补了这一空白。相比 PDX(患者来源异种移植模型),类器官培养成功率更高,成本更低,且符合伦理要求。
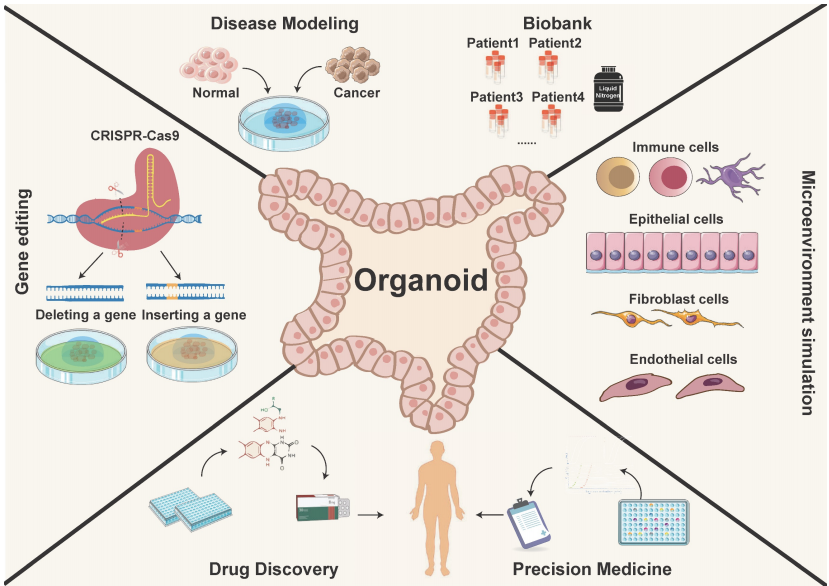
图:类器官模型的应用方向 (Theranostics 2024, Vol. 14, Issue 8)
2024 年全球首个类器官药敏检测专家共识[1]
文献标题:
Building Consensus on the Application of OrganoidBased Drug Sensitivity Testing in Cancer Precision Medicine and Drug Development
期刊:
Theranostics(IF=12.4)
核心贡献:
提出 8 大应用场景,如药物靶点发现、药效评估、生物标志物鉴定、耐药机制研究、联合疗法优化及放疗响应预测等。
制定标准化流程:从 PDOs 培养、药物处理到数据分析,建立全球首个指导框架,为癌症精准治疗和药物开发提供了重要方法论基础。
推动类器官数据获 FDA 等监管机构认可,加速临床转化。
转移性结直肠癌类器官预测化疗疗效研究[3]
文献标题:
Patient-Derived Organoids Model Treatment Response of Metastatic Gastrointestinal Cancers
期刊:
Science(2018年)
关键数据:
71 例患者构建 110 个类器官模型,测试 55 种药物。
阴性预测值达 100%(即类器官无效的药物临床 100% 无效),避免患者承受毒副作用。
典型案例:mCRC 患者 C-002 类器官模型显示西妥昔单抗引发异常增殖,精准预测临床耐药,揭示非 RAS 通路耐药机制。
乳腺癌类器官指导挽救性治疗研究[6]
文献标题:
Patient-Derived Organoids Can Guide Personalized-Therapies for Patients with Advanced Breast Cancer
期刊:
Advanced Science(2021年)
突破性成果:
携带 PIK3CA 突变的类器官对 Alpelisib 敏感,临床验证后患者肿瘤退缩率提升 40%。
三阴性乳腺癌患者通过类器官药敏实验筛选出依维莫司+长春瑞滨联合方案,实现临床缓解。
类器官药敏预测与临床疗效呈现显著相关性。接受类器官预测敏感药物治疗的患者中,83% 实现客观缓解或疾病稳定 (AUC 80.1%) ,突破传统分子分型指导的疗效瓶颈。
创新性发现微管靶向药物敏感特征可预测乳腺癌患者无远处复发生存期显著延长 (p<0.05) ,为化疗方案选择提供了新型生物标志物。
为精准量化药物反应,高内涵筛选技术 (High Content Screening, HCS) 成为核心工具。通过共聚焦成像技术,HCS 可捕获类器官形态、细胞活性及分子标记及动态变化,获取大量细胞表型数据,结合人工智能 (AI) 和机器学习算法,科学家可以从海量数据中挖掘出药物作用的潜在机制,推动类器官药敏检测研究。
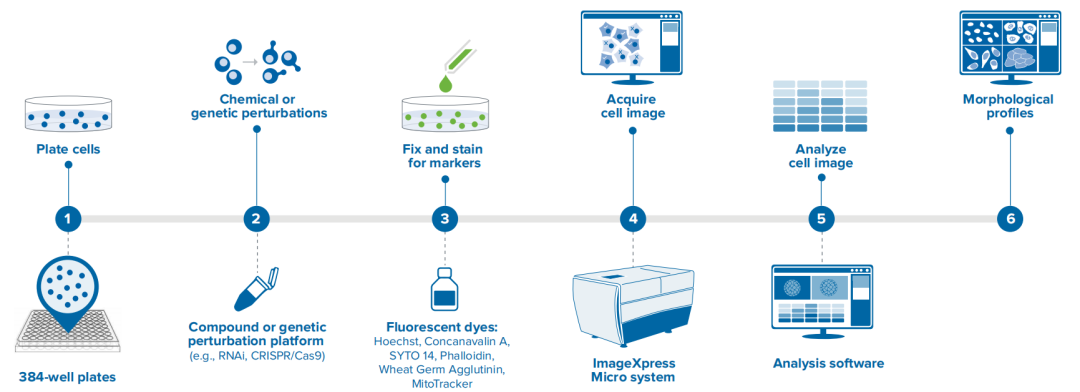
高内涵成像分析系统工作流程图
随着血管化、免疫共培养等技术的突破,类器官药敏检测正迈向功能化、系统化。伴随着 AI 的不断发展,高内涵技术也有望成为药敏检测的重要引擎,为精准医疗的发展提供更多的解决方案。
图:Molecular Devices 公司 2025 年新品 ImageXpress HCS.Ai
参考文献
1. Xiang, D. et al. Building consensus on the application of organoid-based drug sensitivity testing in cancer precision medicine and drug development. Theranostics 14, 3300–3316 (2024).
2. Rumsey, J. W. et al. Classical Complement Pathway Inhibition in a “Human‐On‐A‐Chip” Model of Autoimmune Demyelinating Neuropathies. Adv. Ther. 5, 2200030 (2022).
3. Vlachogiannis, G. et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science 359, 920–926 (2018).
4. Wang, H.-M. et al. Using patient-derived organoids to predict locally advanced or metastatic lung cancer tumor response: A real-world study. Cell Rep. Med. 4, 100911 (2023).
5. Ganesh, K. et al. A rectal cancer organoid platform to study individual responses to chemoradiation. Nat. Med. 25, 1607–1614 (2019).
6. Chen, P. et al. Patient‐Derived Organoids Can Guide Personalized‐Therapies for Patients with Advanced Breast Cancer. Adv. Sci. 8, 2101176 (2021).

关于美谷分子仪器
Molecular Devices 始创于上世纪 80 年代美国硅谷,并在全球设有多个代表处和子公司。2005 年,Molecular Devices 在上海设立了中国代表处,2010 年加入全球科学与技术的创新者丹纳赫集团,2011 年正式成立商务公司:美谷分子仪器 (上海) 有限公司。Molecular Devices 以持续创新、快速高效、高性能的产品及完善的售后服务著称业内,我们一直致力于为客户提供在生命科学研究、制药及生物治疗开发等领域蛋白和细胞生物学的创新性生物分析解决方案。