内容摘要

幽门螺杆菌(H. pylori)感染全球半数人口,是胃癌的主要风险因素。今年4月,中国南方医科大学龚伟团队等在《Nature Communications》杂志上发表了题为“Single-cell RNA sequencing dissects the immunosuppressive signatures in Helicobacter pylori-infected human gastric ecosystem”的论文。该研究通过单细胞RNA测序(scRNA-seq)和T细胞受体(TCR)分析,整合187,192个细胞数据,首次系统揭示H. pylori如何重塑胃部微环境并表现免疫抑制,为开发根治H. pylori的靶向疗法提供了全新思路。
主要结果
1. 抗原呈递细胞(APC)功能全面受损
研究团队对12名感染者与11名非感染者的胃黏膜及外周血样本进行单细胞测序。结果显示:感染后单核细胞、树突状细胞(DC)和巨噬细胞的MHC-II分子表达显著下调,感染者的单核细胞和DC的抗原呈递能力显著下降。研究人员进一步通过Sony SA3800进行小鼠感染模型及人胃组织流式检测,结果显示小鼠外周血与人胃组DC的HLA-DR表达下调,抗原呈递能力受损,同步验证了H. pylori通过抑制APC功能逃避免疫清除。
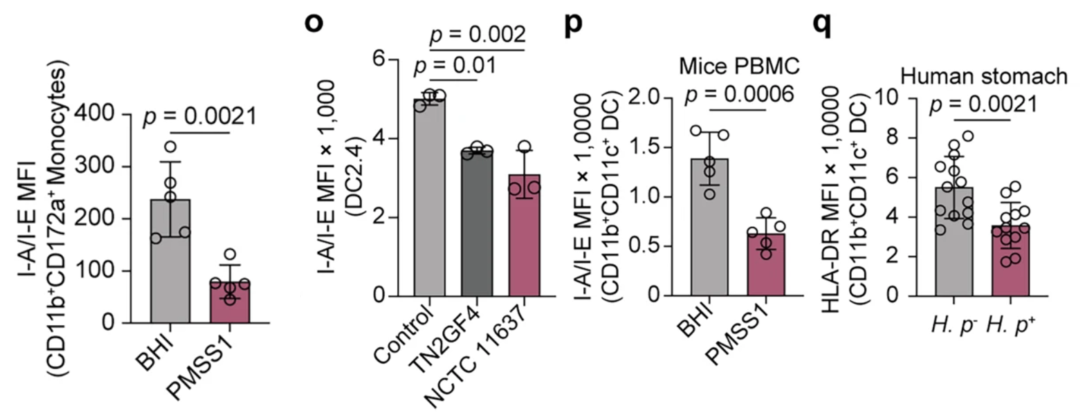
图1. 幽门螺杆菌感染APC的抗原加工和呈递能力受到抑制
2. 单核细胞向免疫抑制性C1QC+巨噬细胞的分化轨迹
通过拟时序分析,研究人员鉴定出两群巨噬细胞亚群:Macro-C1QC和Macro-IFIT1。并通过轨迹分析发现感染幽门螺旋杆菌后一条独特的单核细胞分化路径:单核细胞→ IFIT1+过渡态巨噬细胞 → C1QC+组织驻留巨噬细胞,伴随者MHC-II分子表达显著降与吞噬功能下降。采用Sony SA3800进行的流式实验进一步显示,感染者胃部巨噬细胞的HLA-DR表达水平下降,且体外感染模型证实幽门螺杆菌直接抑制巨噬细胞吞噬功能。
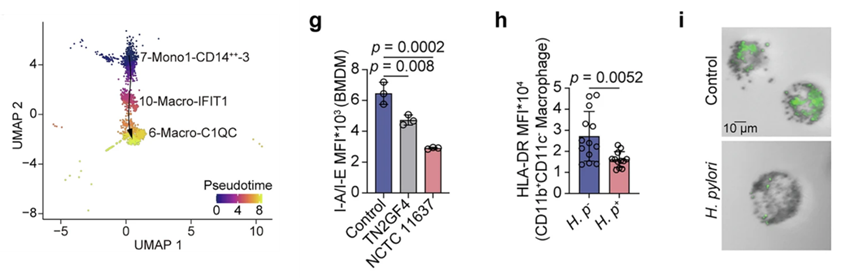
图2. 幽门螺杆菌定植后单核细胞分化的巨噬细胞表现出免疫抑制表型
3. T细胞克隆扩增受限与免疫检查点异常
研究发现H. pylori感染期间T细胞反应普遍受到抑制。TCR 测序显示,幽门螺杆菌感染导致T细胞克隆多样性增加,但黏膜浸润CD4+和CD8+ T细胞克隆扩增显著受限,无法有效清除病原体,削弱抗菌免疫应答。采用Sony SA3800进一步研究发现,在H. pylori阳性胃组织中,CD8+HLA-DR+CTLA4+ T细胞亚群和CD4+HLA-DR+CTLA4+ T细胞亚群均显著富集。单细胞测序结果显示,它们不仅高表达MHC-II相关基因,还高表达抑制性标记,如CTLA4和LAG3,CD8+亚群呈现“耗竭前体”表型,与胃癌中的可塑性耗竭状态类似。
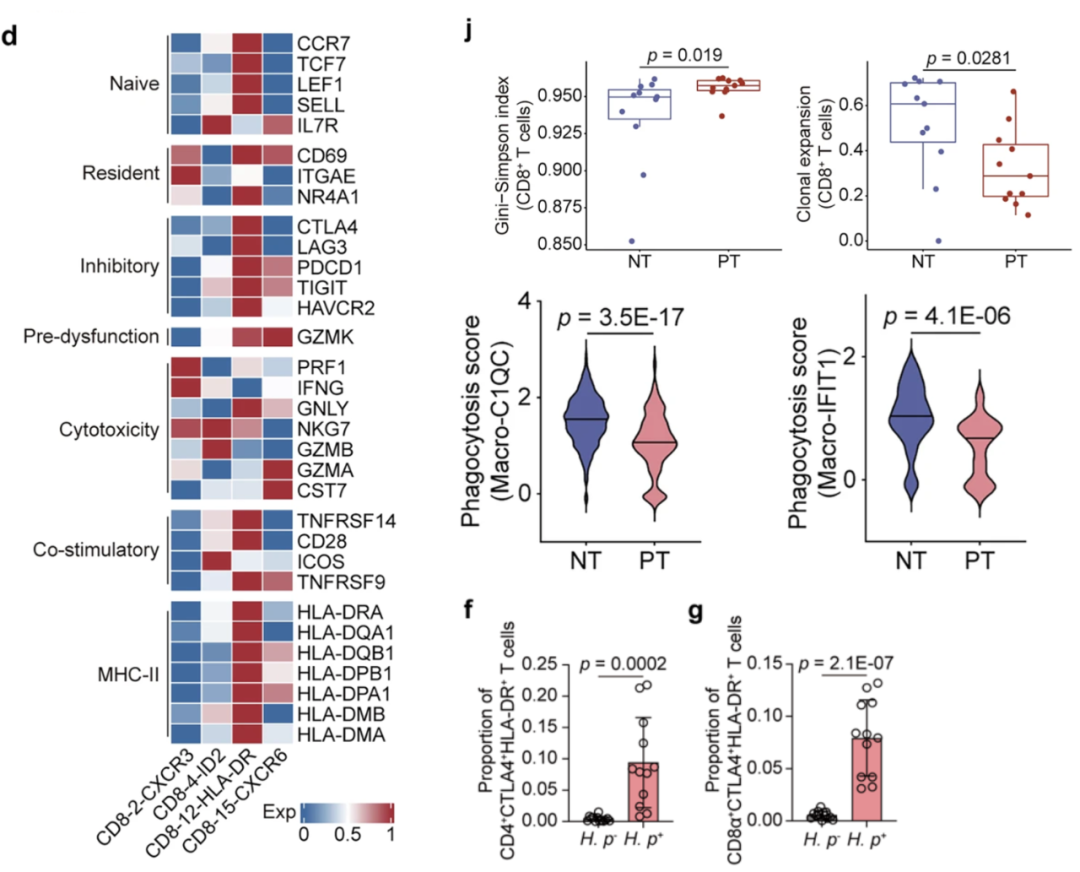
图3. CD8+HLA-DR+CTLA4+T细胞抑制幽门螺杆菌定植后的免疫抑制表型
索尼流式亮点
研究中涉及的流式检测皆采Sony SA3800光谱流式细胞仪完成关键性验证。SA3800采用索尼独创的全光谱检测和分析技术,可以检测真实且完整的全光谱荧光信号,应用光谱解析方法,拆分荧光信号,不需要调节补偿,且具备参照光谱库,可随时反复调用参照光谱,无需反复做单染管。该研究涉及多种样本类型:人/鼠多物种样本,细胞系样本、PBMC样本与珍贵稀有的人胃组织等;检测多种细胞亚群:单核细胞、淋巴细胞、巨噬细胞以及多样本来源的树突状细胞;SA3800的独特设计不仅为其提供更客观且准确的流式数据,参照光谱库的灵活调用还助力其高效检测多种样类型(尤其珍贵稀少的临床样本)的多种细胞亚型,显著提升科研效率。
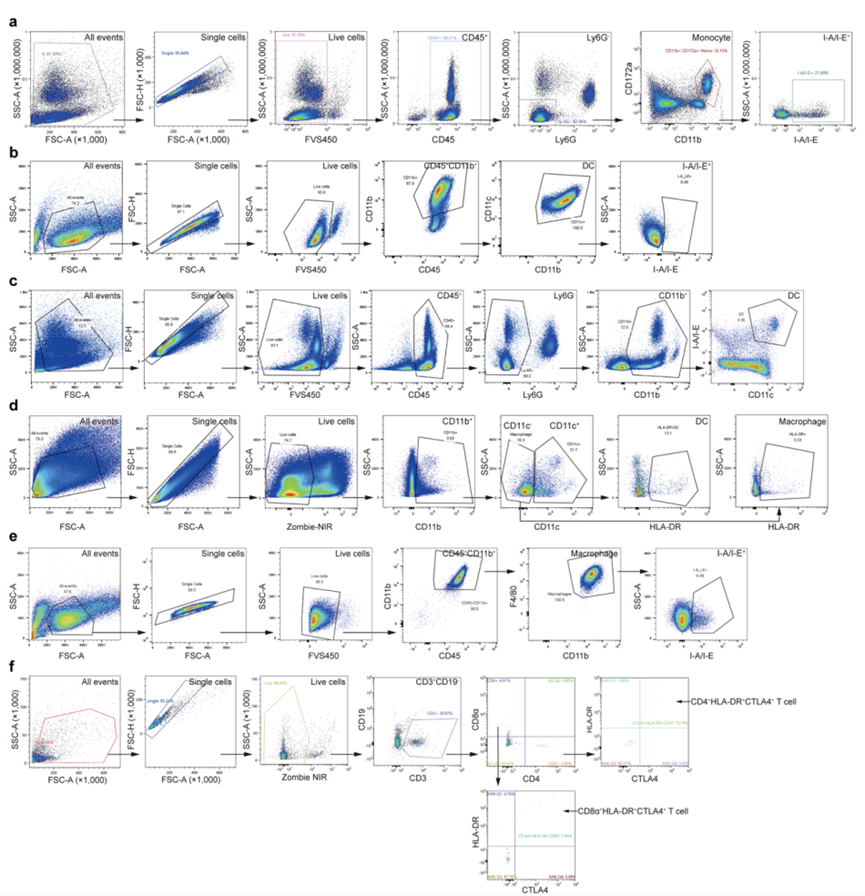
图4.流式圈门策略
(a)小鼠外周血单核细胞(CD45+Ly6G-CD11b+CD172a+)
(b)DC2.4 细胞系中的DCs (CD45+CD11b+CD11c+)
(c)小鼠外周血 DCs (CD45+Ly6G-CD11b+CD11c+)
(d)人胃组织 DCs (CD11b+CD11c+) 和巨噬细胞 (CD11b+CD11c- )
(e)BMDM细胞系中的巨噬细胞 (CD45+CD11b+F4/80+)
(f)人胃组织T细胞(CD4+CTLA4+HLA-DR+)和(CD8α+CTLA4+HLA-DR+)
总结
本研究首次在单细胞层面阐明H. pylori通过抑制APC功能、限制T细胞扩增及驱动CTLA4/CD86免疫抑制轴,塑造胃部免疫耐受微环境。Sony SA3800作为关键技术平台,实现多靶标精准检测,提供高灵敏度数据,从而加速转化医学验证,为靶向CTLA4的免疫治疗提供依据。该工作凸显光谱流式技术在单细胞多组学研究中的不可替代性,为根除幽门螺杆菌提供了新靶点。
参考文献:
Hu, Wei et al. “Single-cell RNA sequencing dissects the immunosuppressive signatures in Helicobacter pylori-infected human gastric ecosystem.” Nature communications vol. 16,1 3903. 25 Apr. 2025, doi:10.1038/s41467-025-59339-4