内容摘要
呼吸道病毒感染在不同个体中的严重程度差异极大,肠道微生物群的组成可能是影响这种差异的重要因素之一。Andrew T. Gewirt研究团队在《Cell Host & Microbe》上发表题为“Intestinal microbiota programming of alveolar macrophages influences severity of respiratory viral infection”的研究表明,肠道分段丝状细菌(SFB, Segmented Filamentous Bacteria)能够显著影响肺泡巨噬细胞(Alveolar Macrophages, AMs)的功能,进而调节呼吸道病毒感染的严重程度。SFB的存在使得AMs获得了更强的抗病毒能力,能够有效减轻病毒感染引起的病理损伤。这一发现不仅证实了肠道微生物与肺部免疫之间的远程调控关系,还为开发基于微生物群调节的呼吸道病毒感染防治策略提供了理论依据。
1
肠道SFB显著减轻流感病毒感染
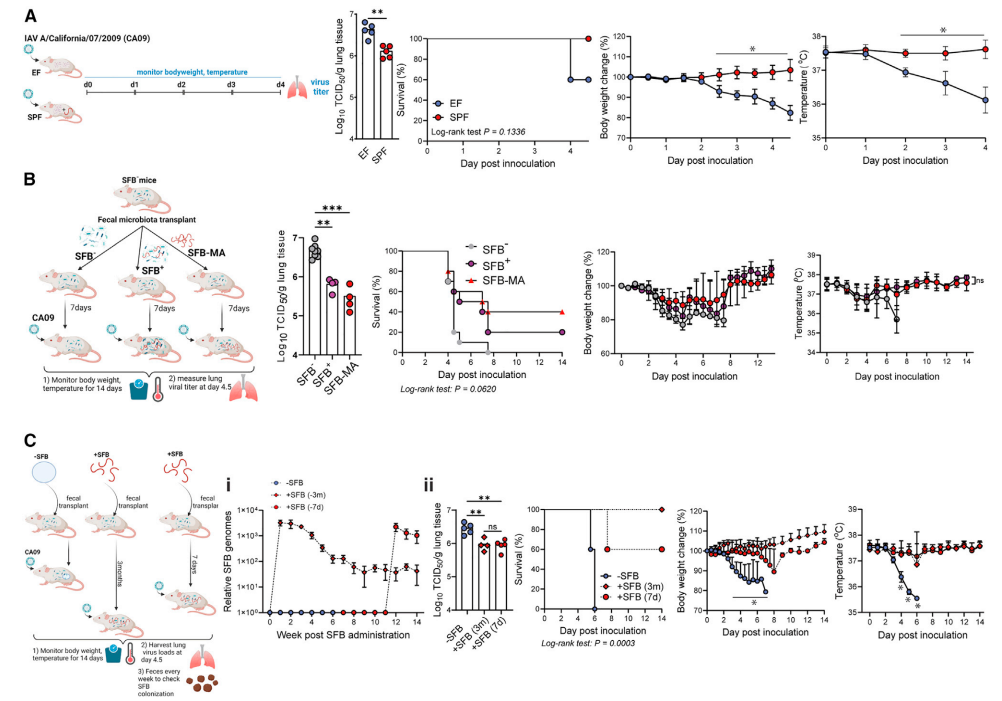
图1. 肠道定植SFB保护小鼠免受流感病毒感染
研究者首先比较了特定病原体自由SPF小鼠和排除特定菌群EF小鼠感染流感病毒H1N1后的表现。结果显示,SPF小鼠的肺部病毒载量显著低于EF小鼠,且没有出现EF小鼠的体温下降和体重减轻现象,表明SPF小鼠对流感病毒更具抵抗力。进一步分析发现,SFB是SPF小鼠中的一种关键菌群,能够为小鼠提供这种保护作用。当研究者通过粪菌移植(FMT)将SFB引入原本缺乏SFB的小鼠体内后,这些小鼠对流感病毒的抵抗力显著增强,病毒载量降低,且感染引起的病理损伤也明显减轻。
2
SFB通过调节肺泡巨噬细胞发挥作用
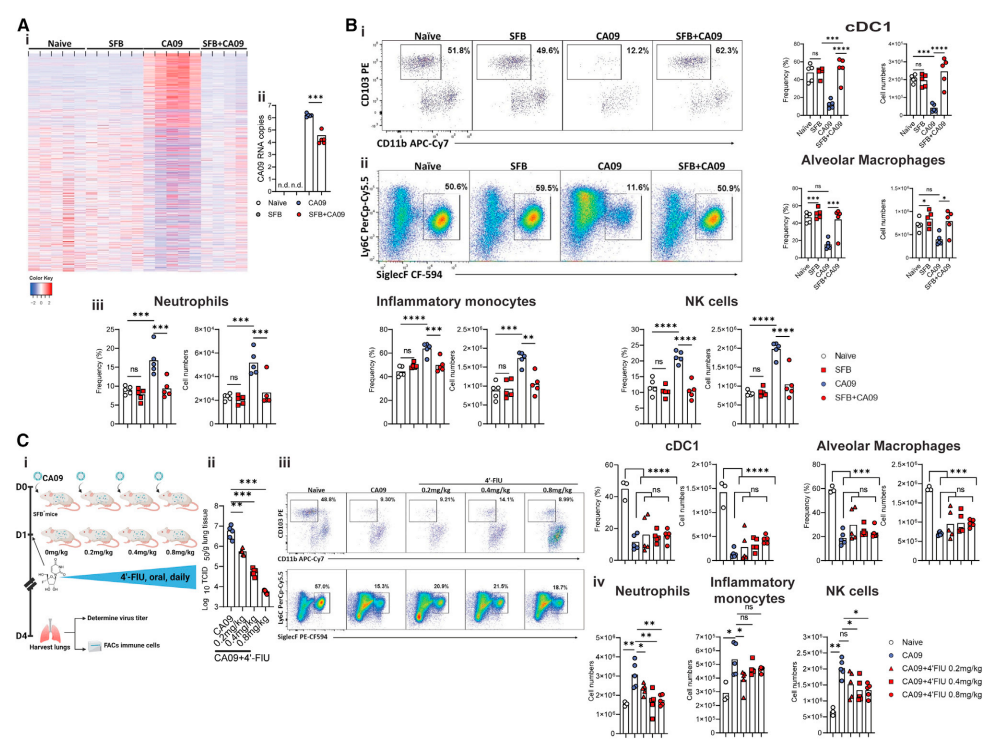
图2. SFB对IAV感染的保护作用与驻留肺吞噬细胞有关
为了探究SFB保护机制,研究者对小鼠肺部的免疫细胞进行分析。他们发现,在流感病毒感染过程中,SFB-小鼠的肺泡巨噬细胞AMs迅速耗竭,而SFB+小鼠的AMs则能够抵抗病毒感染引起的耗竭,并且在炎症信号传导方面表现出显著差异。SFB+的AMs显示出更强大的补体C1qa表达和吞噬能力,能够直接灭活流感病毒,从而降低病毒载量并减轻肺部病理损伤。
3
SFB诱导的AMs表型改变具有细胞内在性
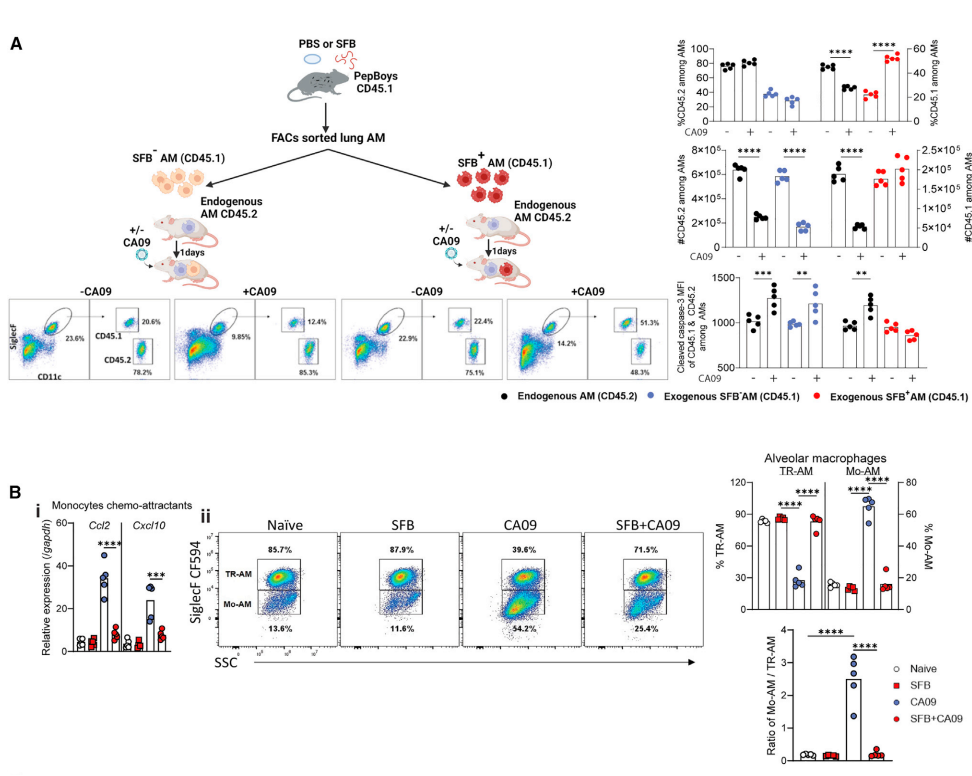
图3. SFB定殖改变了AMs以抵抗IAV诱导的耗竭
研究者进一步通过Sony SH800全自动流式分选技术将SFB+和SFB-的AMs分离出来,并将分选的高活性AMs移植到无SFB的小鼠体内。结果显示,移植的SFB+ AMs能够在受体小鼠中抵抗流感病毒引起的耗竭,而SFB- AMs则不能。这表明SFB对AMs的调节作用是细胞内在的,即SFB能够直接改变AMs的表型,使其获得更强的抗病毒能力,而不是通过改变肺部微环境来间接影响AMs的功能。
流式分选关键应用

在这项研究中,Sony SH800全自动流式细胞分选仪发挥了不可或缺的作用。它不仅高效率、高精度、高活性地分离出目的肺泡巨噬细胞,还为研究者提供了分选下游包括体外培养、病毒灭活以及细胞移植等系列细胞表型和功能深入研究的保障。
通过Sony流式细胞分选技术,研究者准确地比较了SFB阳性与阴性的AMs在细胞表面标志物表达、细胞活性以及对病毒感染的反应等方面的差异。这些细胞水平的精确数据为揭示SFB如何通过调节AMs来影响呼吸道病毒感染的机制提供了关键证据。此外,Sony SH800全自动流式细胞分选仪以其独特的“一体式”进样针和“集成式”微流控芯片的可更换设计,能够无缝切换病毒样本、肠道菌群和普通细胞的分析分选实验,全面杜绝交叉污染,完美诠释一机多用的高效理念。
参考文献:
Ngo VL, Lieber CM, Kang HJ, Sakamoto K, Kuczma M, Plemper RK, Gewirtz AT. Intestinal microbiota programming of alveolar macrophages influences severity of respiratory viral infection. Cell Host Microbe. 2024 Mar 13;32(3):335-348.e8. doi: 10.1016/j.chom.2024.01.002. Epub 2024 Jan 30. PMID: 38295788; PMCID: PMC10942762.