文 章 背 景
心肌梗死(MI)是全球最主要的死亡原因之一,其病理过程涉及复杂的组织修复失衡和炎症反应。传统观点认为,梗死区炎症反应主要由髓系细胞通过识别死亡细胞释放的损伤相关分子模式(DAMPs)启动。然而近些年研究发现,IFN信号通路在病理性重塑中发挥关键作用。但大多数研究集中在心外髓系细胞分泌的IFN或易于检测的ISGs(干扰素刺激基因:是由IFNα和IFNβ刺激局部微环境中细胞,上调表达的多种效应分子总称),而更难检测的心内IFN相关研究甚少。
加州大学圣地亚哥分校K. R. King团队通过Sony MA900多功能自动化分选仪分选不同细胞亚型,结合空间转录组和MERFISH技术,揭示了心肌梗死后损伤边界区域IFN反应的病理机制,为深入了解心肌梗死后的炎症反应和开发靶向治疗策略提供新的视角。

主 要 结 论
心肌梗死边界区存在显著相关的IFNICs集落
作者通过空间转录组学和单细胞MERFISH技术,发现在野生型小鼠的梗死边界区(BZ),形成直径数百微米的干扰素诱导细胞(IFNICs)集落,但在敲除IRF3、CGAS、STING或IFNAR的小鼠中并未出现。说明这些集落与BZ相关,且依赖于CGAS-STING-IRF3通路。在人类心脏标本数据中也发现相似规律。
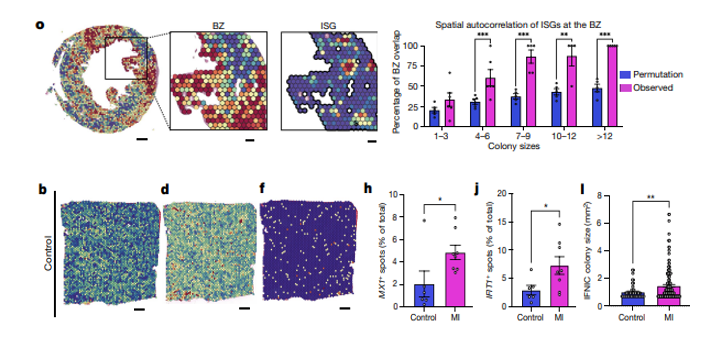
心肌细胞启动IFNICs集落及其原因
心肌细胞特异性敲除IRF3显著减少IFNICs集落,而对成纤维细胞、巨噬细胞、中性粒细胞或内皮细胞敲除则无此效果。CCR2缺陷小鼠和pDCs耗竭小鼠中,IFNICs集落仍然存在。证明心肌细胞是IFN反应的主要启动者。究其原因,主要是因为BZ心肌细胞因机械应力导致的核破裂和DNA泄漏,从而启动IFN反应。
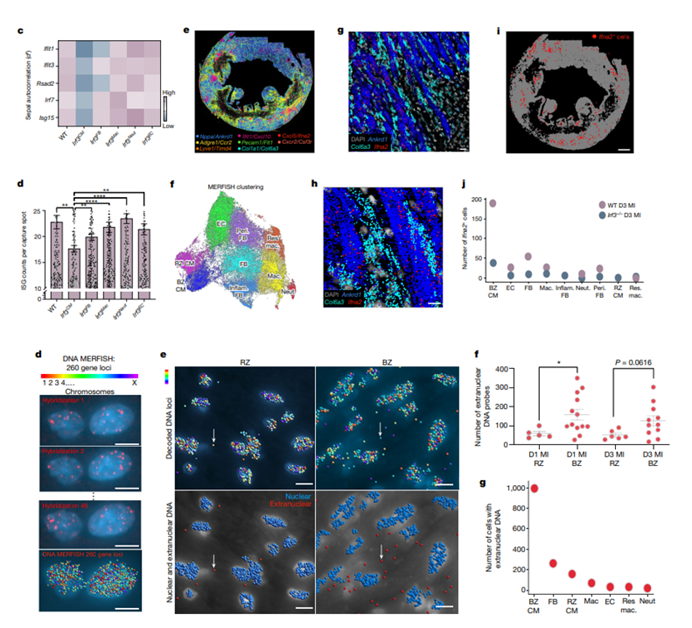
IFNICs集落与左心室病理性重塑和破裂相关
心肌梗死导致左心室(LV)病理性重塑和心力衰竭,并伴随严重并发症心室破。作者观察到在MI猝死小鼠中,IFNICs集落紧邻心室破裂部位。IRF3−/−小鼠破裂率显著降低,生存率提高。
总之,作者揭示了非免疫细胞在心肌梗死后炎症反应中的核心作用,并探索了针对IFNICs集落的靶向治疗,可能通过抑制CGAS-STING-IRF3通路或增强成纤维细胞功能来实现。
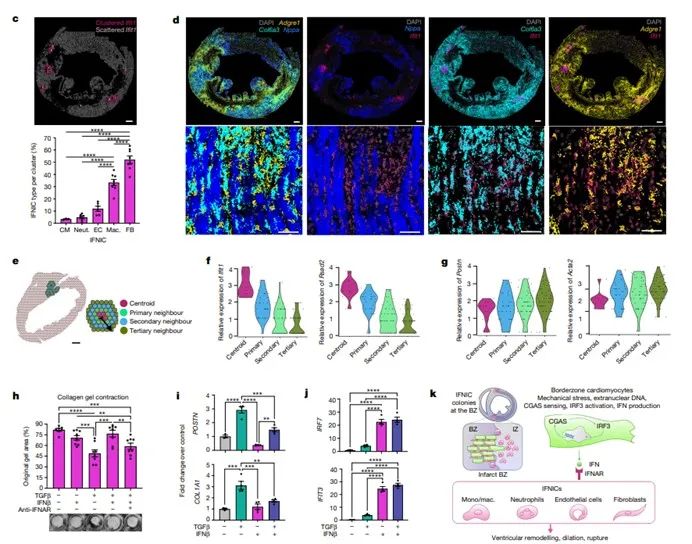
SONY MA900 在课题研究中作用
1. 广泛适用性和高活性:
2. 支持复杂实验设计:
总 结
本研究揭示了心肌梗死后非免疫细胞驱动的MI炎症作用新机制,为靶向IRF3通路治疗缺血性心肌病提供了理论依据。SONY MA900全自动分选仪凭借其多参数分析、高活率柔性分选能力,为复杂的组织微环境的细胞分析分选提供了可靠保障。确保了后续多组学数据的可信度,推动了从机制发现到临床转化的全链条研究。
