动力学读板模式是酶标仪除终点法之外最常用的检测模式,用于测量样品在一段时间内发生的变化,长期动力学测量可用于研究生物学的众多方面,如酶动力学、细胞信号传导和蛋白质表达。
然而,在酶标仪上运行这样一个长期连续动态读取的实验需要占用酶标仪很长一段时间,大大降低了仪器的使用效率。此外,进行一系列终点法读取会产生一个一个的单独数据,必须手动将它们连接在一起才能生成动力学曲线图。使用 Molecular Devices 公司的酶标仪和 SoftMax Pro 软件,研究人员现在可以使用软件的中断和继续读板功能进行长时间测量 (图 1) 。这些功能允许从仪器中移除微孔板进行培养基添加或其他实验,然后恢复动力学读数,同时将所有数据点保留在单个孔板中,以便于分析。
图 1:非连续动力学测量。动态测量可以通过按下中断按钮。要继续收集同一数据文件内的动力学测量值,可按下恢复 (Append) 按钮


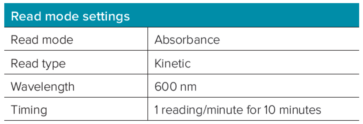
这里向大家介绍如何使用非连续动态读取方式通过 600 nm 的吸光度进行 24 小时细菌生长测量。在时间零点启动了动力学读板。要中断动力学测量,在 SoftMax Pro 软件的“控制与状态”区域点击“中断”按钮。仪器在暂停前完成了所选读取区域中剩余孔的读取。然后将板从酶标仪中取出。对于动力学读取的下一个时间点,将孔板放入酶标仪。打开原始数据文件,点击继续 (Append) 按钮以恢复动力学读取并添加更多数据点 (表 1) 。
表 1:酶标仪设置用于细菌生长曲线的数据采集


继续 (Append) 功能将不连续的测量结果连接成一个连续的细菌生长曲线。在 SoftMax Pro 软件中计算细菌生长曲线的开始时间,比较细菌生长条件。设置数据归一化,计算细菌培养达到 0.6 OD 值所需的起始时间,并计算细菌生长曲线拐点处的斜率 (表 2) 。
表 2:细菌生长的不同参数。SoftMax Pro 软件可用于分析细菌生长的不同阶段。软件可计算出细菌生长到达 0.6 OD 值所用时间

细菌培养会经历四个阶段:延滞期、对数期、稳定期和衰退期 (图 2) 。本实验采集了足够多的数据点,以生成三种不同细菌培养物的细菌生长曲线 (图 3) 。数据显示,每种培养物在不同时间依次经历延滞期、对数期和稳定期。图中未观察到衰退期,因为仪器所采用的光散射法测量的是样本的质量而非单个细胞。死亡细胞仍占据样本的质量,并对光散射产生影响,从而影响 OD 600 值。
图 2:细菌生长阶段。细菌生长的四个不同阶段
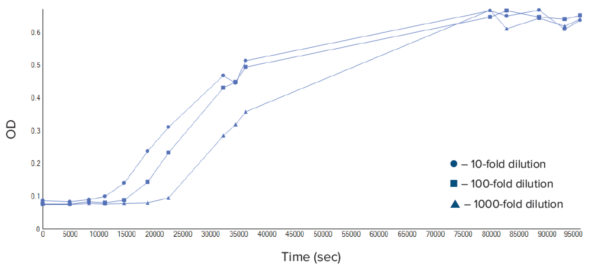
图 3:细菌生长曲线。使用酶标仪和 SoftMax Pro 软件对三种不同稀释度的细菌进行了测量。测量时长为 24 小时。可以看出,即便数据点之间的时间间隔较大,软件仍能将它们连接起来
利用 SoftMax Pro 软件可以计算细胞生长的各种参数。通过计算细菌培养物达到特定光密度时的时间,可以对生长速率进行定量比较。在本实验中,可以观察到在 10 倍稀释的培养物中所需时间最短 (表 2) 。


检测细菌生长曲线的另一个用途是开发和优化检测方法来筛选抗菌化合物,这是许多微生物和药物开发实验室感兴趣的方向。使用 SoftMax Pro 软件中的工作流编辑器 (Workflow Editor) 功能记录细胞密度和转染的 GFP 信号随时间变化的过程,并进行各种数据转换,例如将 GFP 信号归一化为细胞密度,以及提取生长速率或其他动力学相关信息。
本实验使用含有质粒 pMV158-GFP 的粪肠球菌菌株 OG1RF 在不同的生长条件下进行研究。利用 SoftMax Pro 工作流程编辑器 (Workflow Editor) ,创建了一个包含吸光度读数(OD600)和荧光读数(GFP)的动态循环,并在两次读数之间进行 5 秒的孔板线性震荡 (图 4) 。在 600 nm 处测量吸光度(OD600),以确定细菌的生长情况。通过底部读取荧光检测来监测 GFP 表达,作为存活情况的指标,激发波长为 485 nm,发射波长为 515 nm。两条数据轨迹 (吸光度和荧光) 记录在两个独立的孔板区域中。该动态循环被设置为每 15 分钟重复一次,总共持续 18 小时。可选的软件功能允许用户暂停和恢复动态读取,从而在运行过程中添加试剂。所得的双重读取模式动态数据使用 SoftMax Pro 软件进行分析。

图 4:SoftMax Pro 7 工作流编辑器双读取模式动态检测。拖放功能易于创建,并且可以快速设置自定义工作流


通过运算设置界面可以进行高级动态学数据分析。图 5 展示了细菌生长实验的运算方法设置。菜单被分为两个部分:原始数据和数据运算步骤。
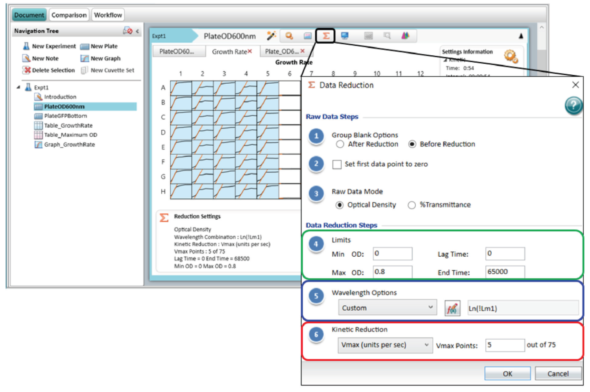
图 5:运算设置菜单中的数据分析选项。此图展示了对孔板截面 OD600nm 的光密度数据进行对数变换,然后用 5 个 Vmax 点将其还原为 Vmax 速率值,以检索曲线最陡的部分
原始数据跟踪与转换 (标准化) 数据跟踪的比较视图如图6所示。
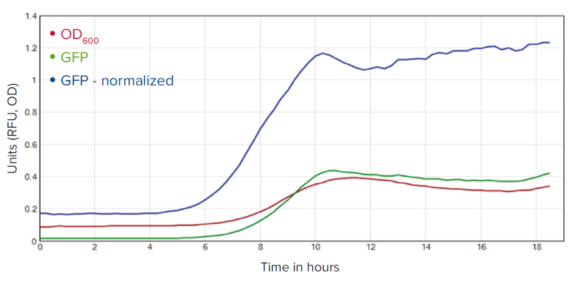
图 6:GFP 信号归一化到 OD600 的细胞密度
当然,也可以将原始数据进行对数转换,并计算出最大生长速率,如图 7。
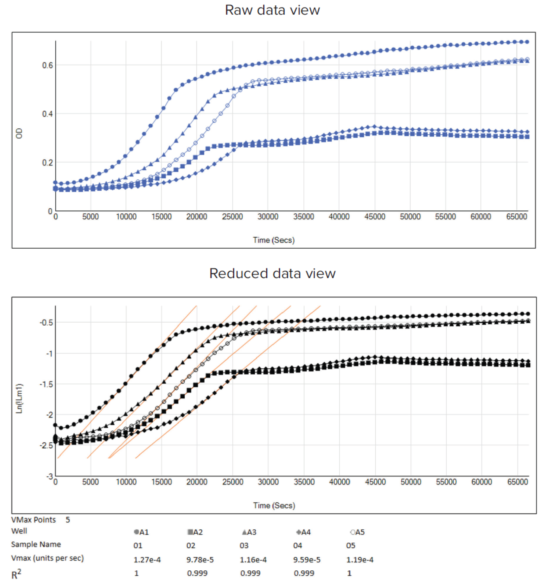
图 7:原始和运算后的数据视图,对 OD600 数据应用对数运算。以 A1 ~ A5 孔为例,分别进行不同的实验条件。上图:OD600 动力学数据轨迹的原始数据 (蓝线) 。下图:使用对数缩放 (黑线) 转换的原始数据,以及通过应用 Vmax 数据运算 (橙线) 确定指数阶段的增长率
为了让用户能够以表格形式直观地比较不同的生长条件 (以数值形式呈现) ,模板编辑工具允许将板布局与样本组进行关联,然后将运算后的数据 (最大增长率) 以表格形式展示出来,如图 8 (上图) 所示。通过后续的计算步骤,可以得到生长速率 (k) 和倍增时间 (g) 。为了更好地进行数据可视化,结果可以以柱状图的形式展示 (图 8,下图) ,以便更轻松地评估生长条件或处理效果。
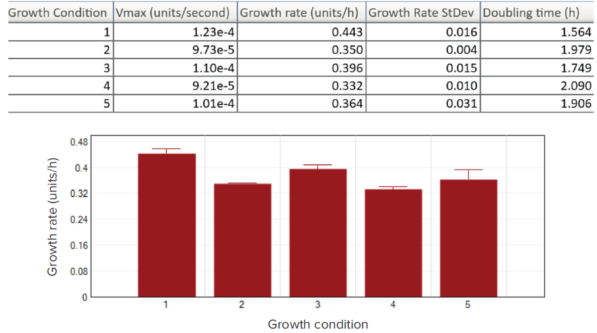
图 8:结果显示选项。将粪肠杆菌运算数据显示及各实验条件下的结果 (第 1 列至第 5 列,n=8) 汇总在结果表中,并以柱状图表示。使用 Vmax 速率展示生长速率 (k=Vmax*3600) 和倍增时间 (g=ln2/k)
综上所述,在以 SpectraMax iD3s 为代表的多功能酶标仪上,利用非连续动力学检测模式和 SoftMax Pro 软件的工作流编辑器 (Workflow Editor) 以及强大的数据计算能力,可以灵活地设计微生物动态监测过程,包括中途添加试剂或药物,两种或多种检测功能按次序自动运行,无需借助第三方软件进行数据处理和曲线图形绘制,帮助我们高效完成微生物相关研究。
